

分析 (1)实验室用氯化铵和氢氧化钙加热制备氨气;
(2)根据氨气与空气密度的相对大小判断排空气的方法,从而确定进气口;
(3)氨气极易溶于水,喷泉实验的原理是形成较大压强差;氨气溶于水生成氨水;
(4)氨气逸散到空气中造成环境污染,利用氨气极易溶于水的性质吸收氨气,注意防止倒吸的发生;
(5)氨气催化氧化生成一氧化氮和水.
解答 解:(1)氯化铵和氢氧化钙加热生成氨气、氯化钙和水,化学方程式:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O;
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O;
(2)氨气密度小于空气的密度,所以要采用向下排空气法收集氨气,即a 为进气口,b为出气口,
故答案为:a;
(3)氨气形成喷泉的原理是由于氨气极易溶于水,氨气溶于水而导致烧瓶内压强减小,从而形成喷泉,依据氨气形成喷泉的原理,如要形成喷泉,烧瓶内气体溶于水导致烧瓶内压强减小,外界大气压将烧杯内液体压入到烧瓶内,从而形成喷泉;氨气溶于水生成氨水,氨水电离出自由移动的氢氧根离子,所以溶液呈碱性,加入酚酞后溶液呈红色,
故答案为:关闭a、b处止水夹,打开下方止水夹,用手(或热毛巾)捂热烧瓶,使氨气受热膨胀,赶出玻璃管内空气,氨气与水接触形成喷泉;极易溶于水,与水反应生成碱;
(4)氨气极易溶于水,吸收氨气应防止倒吸的发生,可以用②④⑤装置吸收;
故答案为:②④⑤;
(5)氨气催化氧化生成一氧化氮和水,化学方程式:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.
点评 本题考查氨气的制取和性质检验,熟练掌握实验室中制取氨气的反应原理,氨气的性质,防倒吸的原理,是解答本题的关键,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
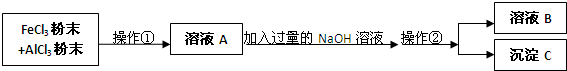
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯气与通入冷的消石灰中反应制漂白粉:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| B. | 向较浓的Na2SiO3溶液中滴加适量盐酸制得硅酸胶体:Na2SiO3+2HCl═2NaCl+H2SiO3(胶体) | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O═Fe3O4+4H2↑ | |
| D. | 用氢氟酸刻蚀玻璃:SiO2+4HF═SiF4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态 | |
| B. | 增大容器的体积,化学平衡不移动,反应速率也不变 | |
| C. | 升高温度使c(B)增大,可知正反应为放热反应 | |
| D. | 加入催化剂,改变了反应历程,但反应的△H不会变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 离子半径:W3+>Y2- | ||
| C. | 原子序数:X+M>Y+W | D. | 单质沸点:M>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸性溶液中:Na+、CO32-、NH4+、NO3- | |
| B. | 无色溶液中:Cl-、H+、Cu2+、SO42- | |
| C. | 使石蕊试液变蓝的溶液中:CO32-、Na+、MnO4-、K+ | |
| D. | 含SCN-的溶液中:K+、NH4+、Cl-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
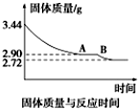 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题: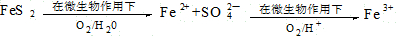
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com