
| A. | 水中加入明矾,可以起到杀菌消毒的作用 | |
| B. | 氧化铝中加入冰晶石,可以起到降低熔点的作用 | |
| C. | 药皂中加入少量苯酚,可以起到增白去污的作用 | |
| D. | 食品包装袋中放入生石灰,可以起到防止月饼等富脂食品氧化变质的作用 |
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | X的氢化物的沸点可能高于Y的氢化物的沸点 | |
| B. | 原子半径比较:X<Y<Z<W | |
| C. | X2H4与H2W都能使溴水褪色,且褪色原理相同 | |
| D. | 短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
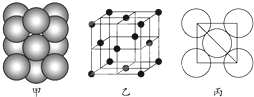 现有A、B、C、D、E、F六种元素,其中前四种为短周期主族元素,后两种为第四周期元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期;C原子核外所有p轨道全满或半满;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第七列.请根据以上相关信息,回答下列问题.
现有A、B、C、D、E、F六种元素,其中前四种为短周期主族元素,后两种为第四周期元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期;C原子核外所有p轨道全满或半满;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第七列.请根据以上相关信息,回答下列问题. 如图,违背了泡利不相容原理.
如图,违背了泡利不相容原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
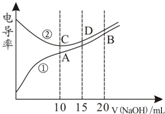 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定HCl溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A | |
| D. | D点溶液中:2c(Na+)=3c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 解释或结论 |
| A | 用洁净的Pt蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,无k+ |
| B | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧 | CO2、H2O与Na2O2反应是放热反应 |
| C | 向溴水中滴入植物油,振荡后,油层显无色 | 溴不溶于油脂 |
| D | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 | H2O2的氧化性比Fe3+强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时反应为:4VB2+11O2→4B2O3+2V2O5.下列说法正确的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时反应为:4VB2+11O2→4B2O3+2V2O5.下列说法正确的是( )| A. | 电极a为电池负极,发生还原反应 | |
| B. | 每消耗1mol VB2转移6mol电子 | |
| C. | 电池工作时,OH-向电极a移动 | |
| D. | VB2极发生的电极反应为:2VB2+22OH--22e-→V2O5+2B2O3+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径大小比较:r(N3-)>r(O2-) | |
| B. | N元素与氧元素形成的化合物只有五种 | |
| C. | 在该反应条件下,NH3的还原性弱于的H2O还原性 | |
| D. | 在该反应中,反应物的总能量小于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
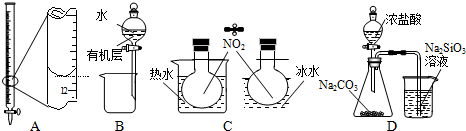
| A. | 装置A记录滴定终点读数为12.20 mL | |
| B. | 装置B可用于提取I2的CCl4溶液中的I2 | |
| C. | 装置C可用于探究温度对2NO2?N2O4平衡体系的影响 | |
| D. | 装置D可用于比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
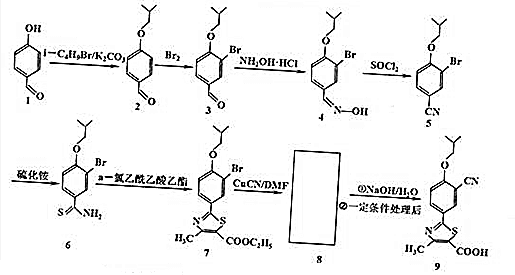
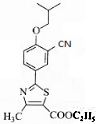 .
.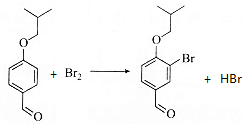 .
. .
.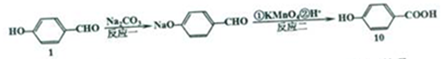
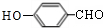 +Na2CO3→
+Na2CO3→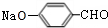 +NaHCO3,其目的是保护酚羟基,防止为氧化.
+NaHCO3,其目的是保护酚羟基,防止为氧化.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com