

分析 工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,先加过量铁,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,结合流程可知,操作a为过滤,过滤出Cu,Fe,滤液是FeSO4,Cu、Fe中加入H2SO4,铁与硫酸反应,铜不反应,操作b为过滤,得到Cu,滤液中主要含FeSO4,操作c为蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,以此来解答.
解答 解:工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,先加过量铁,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,结合流程可知,操作a为过滤,过滤出Cu,Fe,滤液是FeSO4,Cu、Fe中加入H2SO4,铁与硫酸反应,铜不反应,操作b为过滤,得到Cu,滤液中主要含FeSO4,操作c为蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,
(1)由以上分析可知操作a为过滤,故答案为:过滤;
(2)加入甲为铁粉,乙为稀硫酸,故答案为:c、b;
(3)c为蒸发,用到的仪器有蒸发皿、玻璃棒以及酒精灯,故答案为:b c d;
(4)FeSO4?7H2O变质可生成铁离子,可加入KSCN检验,方法为取少量固体溶解于试管中,加入适量 KSCN 溶液,溶液变为血红色则产品变质,
故答案为:取少量固体溶解于试管中,加入适量 KSCN 溶液,溶液变为血红色则产品变质;
(5)最终得到FeSO4?7H2O27.8g,则n(FeSO4?7H2O)=$\frac{27.8g}{278g/mol}$=0.1mol,加入甲物质质量为4.2g,可知n(Fe)=$\frac{4.2g}{56g/mol}$=0.075mol,
则原试样中c(Fe2+)=$\frac{0.1mol-0.075mol}{0.01L}$=2.5mo l•L-1,
故答案为:2.5mo l•L-1.
点评 本题考查回收硫酸亚铁和铜的实方案设计,侧重于学生的分析、实验和计算能力的考查,题目难度中等,注意根据物质的性质选择分离提纯的方法,特别是过滤和蒸发结晶操作,注意把握所使用仪器和操作步骤.


科目:高中化学 来源: 题型:解答题
 我国部分城市灰霾天占全年一半.引起灰霾的PM2.5微细粒子包含(NH4)2S04、NH4N03、有机颗粒物及扬尘等.通过测定灰霾中锌等重金属的含量,可知交通污染是目前造成我国灰霾天气主要原因之一.
我国部分城市灰霾天占全年一半.引起灰霾的PM2.5微细粒子包含(NH4)2S04、NH4N03、有机颗粒物及扬尘等.通过测定灰霾中锌等重金属的含量,可知交通污染是目前造成我国灰霾天气主要原因之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为SO2,则丁可能是氨水 | ||
| C. | 若甲为Fe,则丁可能是氯气 | D. | 若甲为NaOH溶液,则丁可能是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两份质量相同的镁分别与足量氮气、二氧化碳反应,增重的质量相同 | |
| B. | 两份质量相同的硫分别与足量氢氧化钠和钠反应,两者转移的电子数相同 | |
| C. | 相同物质的量CO2、H2O分别与足量Na2O2反应,生成气体的体积相同 | |
| D. | 氢气分别通过灼热的CuO和Fe2O3粉末,当转移电子数相同时,固体减轻的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
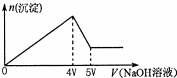 向MgCl2、Al2(SO4)3的混合溶液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则原溶液中Mg2+与Al3+的物质的量之比是( )
向MgCl2、Al2(SO4)3的混合溶液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则原溶液中Mg2+与Al3+的物质的量之比是( )| A. | 1:2 | B. | 1:1 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1KHS溶液中c(HS-)+c(S2-)+c(H2S)=0.1mol•L-1 | |
| B. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | pH=11的NaOH溶液与pH=3的CH2COOH溶液等体积混合后c(CH2COO-)>c(Na+)>c(H+)>c(0H-) | |
| D. | 在K2CO3溶液中:c(CO32-)+c(OH-)=c(HCO3-)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com