
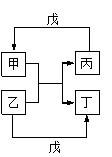
甲、乙、丙、丁、戊的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化)。下列各组物质中,满足图示转化关系的是
| 物质 选项 | 甲 | 乙 | 丙 | 戊 | 丁 |
| A | Cu | HNO3 | Cu(NO3)2 | Fe | NO |
| B | H2O | Fe | H2 | O2 | Fe2O3 |
| C | Al | NaOH | H2 | Al2O3 | NaAlO2 |
| D | CH3CHO | O2 | CH3COOH | H2 | H2O |
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。

请回答下列问题:
(1)图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是____________________________;
(2)图中ΔH=________kJ·mol-1;
(3)V2O5的催化循环机 理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:_____________________________________________;
理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:_____________________________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程)。(已知燃烧热是指25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量)
查看答案和解析>>
科目:高中化学 来源: 题型:
在探究氯水成分的实验中,下列根据实验现象得出的结论错误的是( )
| 实验序号 | 实验现象 | 实验结论 |
| A | 氯水呈浅绿色 | 氯水中含有含有Cl2 |
| B | 向FeCl2溶液中滴加氯水,溶液变成棕黄色 | 氯水中含有HClO |
| C | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀 | 氯水中含有Cl﹣ |
| D | 向氯水中加入NaHCO3粉末,有气泡产生 | 氯水中含有H+ |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验.

已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10﹣5,其饱和溶液中c(OH﹣)约为1×10﹣3mol•L﹣1.请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式: .
(2)上述流程中两次使用试剂①,推测试剂①应该是 A (填以下字母编号)
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是 ;(任写一点)
(4)固体E为 ,写出溶液F通入过量CO2生成固体G和溶液H的化学方程式: .
(5)计算溶液F中c(Mg2+)= (25℃时,氢氧化镁的Ksp=5.6×10﹣12)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质和该性质的应用均正确的是
A.浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体
B.二氧化硫具有漂白性,可用于加工食品使食品增白
C.铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料
D.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.合成氨工业中,移走NH3可增大正反应速率,提高原料转化率
B.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液
C.将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深
D.牺牲阳极的阴极保护法和外加直流电的阴极保护法都是应用电解原理
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)  1/4CaS(s)+CO2(g) ∆H1
1/4CaS(s)+CO2(g) ∆H1
②CaSO4(s)+CO(g)  CaO(s)+CO2(g) +SO2(g) ∆H2
CaO(s)+CO2(g) +SO2(g) ∆H2
③CO(g)  1/2C(s)+1/2CO2(g) ∆H3
1/2C(s)+1/2CO2(g) ∆H3
则反应2CaSO4(s)+7CO(g)  CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)的∆H=
CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)的∆H=
 (用∆H1、∆H2和∆H3表示)
(用∆H1、∆H2和∆H3表示)
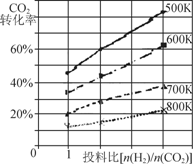
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料
比时,CO2的转化率如右图所示。该反应的ΔH
____(填“>”“<”或“=”)0。若温度不变,减
小反应投料比[n(H2) /n(CO2)],则K将 (填“增大”“减小”或“不变”)。
③二甲醚燃料电池具有启动快,效率高等优点,若电解质为酸性,二甲醚燃料电池的负极反应为 。
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2nCu+(n+1)O2+(2-2n) H2O=2nCuSO4+(2-2n) H2SO4
 从环境保护的角度看,催化脱硫的意义为
从环境保护的角度看,催化脱硫的意义为
。
②利用右图所示电化学装置吸收另一部分SO2,
并完成Cu的再生。写出装置内所发生反应的
总的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在C(s)+CO2(g)2CO(g)反应中,可使反应速率增大的措施是 ( )
①增 大压强 ②增加炭的量 ③通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥通入CO
大压强 ②增加炭的量 ③通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥通入CO
A.①③④ B.②④⑥ C.①③⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下可实现如图所示物质之间的变化:
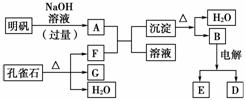
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,上图中的F是________。
(2)写出明矾与过量NaOH溶液反应的离子方程式:
________________________________________________________________________
________________________________________________________________________。
(3)图中所得G和D都是固体,混合后在高温下可发生反应,写出该反应的化学方程式:____________________________。
(4)每生成1 mol D,同时生成________mol E。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com