
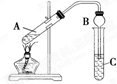
 某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL 冰醋酸混合,分别进行制取乙酸乙酯的研究.
某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL 冰醋酸混合,分别进行制取乙酸乙酯的研究.| 组 序 号 | 催化剂 | 反应现象 | C中饱和碳 酸钠溶液中 酯层高度 |
| ① | 2mL 98% 浓硫酸 | 20秒时溶液出现棕色,随反应进行,溶液颜色逐步加深,最后成黑色;酯层无气泡 | 2.10cm |
| ② | 2mL 14mol?L-1 硫酸 | 反应后溶液呈浅棕色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.14cm |
| ③ | 2mL 10mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.16cm |
| ④ | 2mL 7mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠界面有气泡 | 2.00cm |
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、pH=4的醋酸中:c(H+)=4.0mol?L-1 |
| B、pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
| C、饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D、饱和小苏打溶液中:c(Na+)=c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、得到澄清透明的溶液 |
| B、所得溶液的pH为7 |
| C、取少量所得溶液,加KHCO3,无明显现象发生 |
| D、另取少量所得溶液,加入几滴KOH溶液,有白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大 |
| B、甲烧杯中的酸过量 |
| C、两烧杯中生成氢气的速率相等 |
| D、反应开始后乙烧杯中c(H+)始终比甲烧杯中c(H+)小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com