
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)分析 (1)根据基态原子核外电子排布式中最后填充电子的能级确定,溴是35号元素,处于第四周期ⅦA族;
(2)第一电离能是指原子失去一个电子所需的能量,第一电离能越小,就越容易失去一个电子;
(3)含氧酸中,含非羟基氧原子个数越多,酸性越强(或者同种元素含氧酸中心元素化合价越高,酸性越强);
(4)在离子晶体中离子半径越小、离子所带电荷越高,晶格能越大;
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子,则Cl原子杂化轨道数目为4;原子总数相等、价电子总数也相等的微粒互为等电子体;
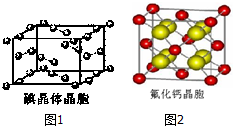
(6)碘为分子晶体,晶胞中碘分子的排列有2种不同的取向,在顶点和面心不同,层内以4配位数交替配位形成层结构,分子内I原子之间形成非极性键,而分子之间为范德华力,根据均摊法计算晶胞中I原子数目;
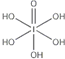
(7)根据均摊法可知晶胞中红色球数目为4、黄色球数目为8,结合化学式可知红色球为Ca2+、黄色球为F-,假设CaF2的相对分子质量为M,表示出晶胞质量,两个离得最近的钙离子是位于顶点和面心上的,则晶胞面对角线长度为2a c,故晶胞棱长为2a cm×$\frac{\sqrt{2}}{2}$=$\sqrt{2}a$ cm,再结合m=ρV计算.
解答 解:(1)卤族元素位于周期表中ⅦA族,外围电子排布式为ns2np5,电子最后填充p能级,属于p区元素,溴处于第四周期ⅦA族,价电子排布式为4s24p5,
故答案为:p;4s24p5;
(2)碘的第一电离能越小,碘更容易形成较稳定的单核阳离子,
故答案为:碘;
(3)H5IO6(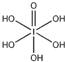 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,
故答案为:<;
(4)CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,由于氯离子的半径小于碘离子,所以CsCl的晶格能大于CsI的晶格能,按反应CsICl2=CsCl+ICl进行,
故选:A;
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子,则Cl原子杂化轨道数目为4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,与ClO2-互为等电子体的为Cl2O等,
故答案为:sp3;Cl2O;
(6)A.碘分子的排列有2种不同的取向,在顶点和面心不同,层内2种取向不同的碘分子以4配位数交替配位形成层结构,故A正确;
B.用均摊法可知平均每个晶胞中碘分子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,即有8个碘原子,故B错误;
C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故C错误;
D.分子内I原子之间形成非极性键,而分子之间为范德华力,故D正确;
故答案为:AD;
(7)根据均摊法可知晶胞中红色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、黄色球数目为8,结合化学式可知红色球为Ca2+、黄色球为F-,假设CaF2的相对分子质量为M,则晶胞质量为4×$\frac{M}{{N}_{A}}$g,两个离得最近的钙离子是位于顶点和面心上的,则晶胞面对角线长度为2a c,故晶胞棱长为2a cm×$\frac{\sqrt{2}}{2}$=$\sqrt{2}a$ cm,则4×$\frac{M}{{N}_{A}}$g=ρg/cm3×($\sqrt{2}a$ cm)3,解得M=$\frac{\sqrt{2}}{2}$ρNAa3,
故答案为:$\frac{\sqrt{2}}{2}$ρNAa3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、分子结构与性质、杂化方式、等电子体、晶胞结构与计算等知识点,需要学生具备扎实的基础与灵活运用能力,需要学生具备一定的空间想象与数学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体 | |
| B. | 碳在空气中燃烧,发出白光,生成使澄清石灰水变浑浊的气体 | |
| C. | 红磷在空气中燃烧,产生大量白色烟雾 | |
| D. | 将分别装有氨水和酚酞溶液的两只烧杯靠近,氨水先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,将1 mol N2和3 mol H2混合发生反应,转移的电子总数为6 NA | |
| B. | 1 L 0.1 mol•L-1的Na2CO3溶液中阴离子的总数大于0.1 NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有2 mol Fe2+被氧化时,消耗Cl2的分子数为NA | |
| D. | 1 mol-CH3中所含的电子总数为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
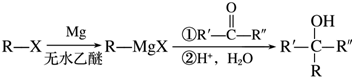 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,0.1mol•L-1的HX溶液与0.1mol•L-1的某一元碱ROH溶液加水稀释,两溶液pH与加水体积变化曲线如图,下列说法正确的是( )
常温下,0.1mol•L-1的HX溶液与0.1mol•L-1的某一元碱ROH溶液加水稀释,两溶液pH与加水体积变化曲线如图,下列说法正确的是( )| A. | HX为一种弱酸,ROH为弱碱 | |
| B. | a、b两点由水电离出c(H+)均为10-12mol•L-1 | |
| C. | 两溶液等体积混合 c(X-)=c(R+) | |
| D. | 两溶液等体积混合c(R+)>c(X-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ | B. | Cl- | C. | OH- | D. | CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用碳捕集和储存技术,逐步实现二氧化碳的零排放 | |
| B. | 扩大铅蓄电池、汞锌锰等含重金属元素的干电池的生产,满足消费需求 | |
| C. | 对工业废水、生活污水净化处理,减少污染物的排放 | |
| D. | 催化处理汽车尾气,减轻氮氧化物污染和光化学烟雾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com