
25℃时,下图烧杯中各盛有25mL的溶液.
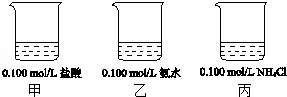
(1)甲溶液pH=1.
(2)若将甲溶液全部倒入乙中,所得的混合溶液的pH(填“>”、“<”或“=”) 丙溶液的pH.
(3)若将乙溶液全部倒入丙中,所得的混合溶液pH>7,所得溶液中离子浓度大小顺序是 .
考点: pH的简单计算;酸碱混合时的定性判断及有关ph的计算.
专题: 电离平衡与溶液的pH专题.
分析: (1)pH=﹣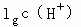 ;
;
(2)等体积等物质的量浓度的盐酸和氨水恰好反应生成氯化铵,氯化铵是强酸弱碱盐,其溶液呈酸性,浓度不同的氯化铵溶液,浓度越小,其溶液的PH越大;
(3)若将乙溶液全部倒入丙中,所得的混合溶液pH>7,说明一水合氨是电离程度大于铵根离子的水解程度,根据溶液的酸碱性结合电荷守恒确定离子浓度大小.
解答: 解:(1)氯化氢是强电解质,在水中完全电离,所以c(H+)=c(HCl)=0.100mol/L,所以pH=﹣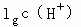 =﹣lg0.100=1,故答案为:1;
=﹣lg0.100=1,故答案为:1;
(2)等体积等物质的量浓度的盐酸和氨水恰好反应生成氯化铵,氯化铵是强酸弱碱盐,其溶液呈酸性,溶液混合时体积增大一倍,浓度是丙中的一半,氯化铵的浓度越小,其酸性越弱,所以混合溶液的pH大于丙,
故答案为:>;
(3)若将乙溶液全部倒入丙中,所得的混合溶液pH>7,说明一水合氨是电离程度大于铵根离子的水解程度,所以得c(OH﹣)>c(H+),溶液中存在电荷守恒,c(NH4+)+c(H+)=c(Cl﹣)+c(OH﹣),所以得c(NH4+)>c(Cl﹣),则溶液中离子浓度大小顺序是c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+),
故答案为:c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+).
点评: 本题考查了pH的简单计算、离子浓度大小的比较等知识点,根据pH的计算公式及电荷守恒来分析即可,难度不大.


科目:高中化学 来源: 题型:
Li﹣Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e﹣=Li2S+Fe.有关该电池的下列说法中,正确的是()
A. Li﹣Al在电池中作为负极材料,该材料中Li的化合价为+1价
B. 该电池的电池反应式为:2Li+FeS=Li2S+Fe
C. 负极的电极反应式为Al﹣3e﹣=Al3+
D. 充电时,阴极发生的电极反应式为:Li2S+Fe﹣2e﹣=2Li++FeS
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同状况下,一个空瓶,若装满O2称其质量为36g,若装满CO2称其质量为42g,若装满A气体,称其质量为52g,则A的相对分子质量是()
A. 16 B. 32 C. 64 D. 128
查看答案和解析>>
科目:高中化学 来源: 题型:
对某酸性溶液(可能含有I﹣、Cl﹣、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;
③加入氯水和CCl4振荡静置后,下层呈紫红色,取上层溶液少许,向其中加入AgNO3溶液时,产生的白色沉淀不溶于稀硝酸.
对于下列微粒不能确认其在溶液中是否存在的是()
A. I﹣ B. Cl﹣ C. H2SO3 D. NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物D为烃类化合物,质谱图表明其相对分子质量为56,其相关反应如下图所示.其中A、C、E的结构中均含有2个﹣CH3,且它们的核磁共振氢谱中均出现3个峰.
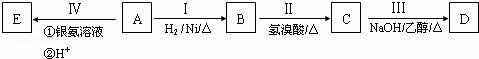
请回答:
(1)D的分子式为C4H8.
(2)写出下列反应的化学方程式:
Ⅱ:
Ⅲ:
(3)与D具有相同官能团的一种同分异构体存在顺反异构,请写出此反式结构的结构简式
(4)已知D经过反应可制得有机玻璃的单体F: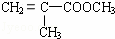 ,由单体F制有机玻璃的反应类型是 高聚物的结构简式是
,由单体F制有机玻璃的反应类型是 高聚物的结构简式是
(5)已知D经过反应可制得G: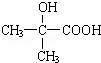 ,写出由G作为单体在一定条件下生成聚酯的化学方程式:
,写出由G作为单体在一定条件下生成聚酯的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法不正确的是()
A. NaClO溶液的消毒原理是使蛋白质变性
B. 1 mol Cl2与足量NaOH溶液反应转移2 mol电子
C. NaClO溶液的漂白原理与Na2O2相同,与SO2不同
D. “84”消毒液与“洁厕灵”(盐酸)混合使用可能会产生有毒的氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
将紫色石蕊试液滴入NaOH溶液中,溶液变蓝色,再通入氯气,溶液由蓝色先变成红色,最后颜色慢慢退去,其原因是()
①氯气有漂白性②氯气与NaOH溶液反应③氯气的水溶液呈酸性④次氯酸有漂白性⑤氯化钠有漂白性.
A. ①④ B. ②③④ C. ①②③ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
用饱和的FeCl3溶液制取Fe(OH)3胶体,正确的操作是( )
|
| A. | 将FeCl3溶液滴人蒸馏水中 |
|
| B. | 将FeCl3溶液滴人热水中,生成棕黄色液体 |
|
| C. | 将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色液体 |
|
| D. | 将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com