
| A. | 常温常压下,22.4L氧气与金属钠完全反应,转移的电子数一定是4NA | |
| B. | 常温常压下,1.7gH2O2中含有电子数为0.9NA | |
| C. | 1L 0.2 mol•L-1 FeCl3溶液中,含有Fe3+粒子数为0.2 NA | |
| D. | 标准状况下,0.1mol 甲苯所含C-C键数为0.6NA |
分析 A、常温常压下,气体摩尔体积的数值大于22.4L/mol,且反应后氧元素可能为-2价或-1价;
B、求出双氧水的物质的量,然后根据1mol双氧水中含18mol电子来分析;
C、Fe3+是弱碱阳离子,在溶液中会水解;
D、甲苯的苯环不是单双键交替的结构.
解答 解:A、常温常压下,气体摩尔体积的数值大于22.4L/mol,故22.4L氧气的物质的量小于1mol,且反应后氧元素可能为-2价或-1价,故转移的电子的物质的量小于4mol或2mol,故A错误;
B、1.7g双氧水的物质的量n=$\frac{1.7g}{34g/mol}$=0.05mol,而1mol双氧水中含18mol电子,故0.05mol双氧水中含0.9mol电子,即0.9NA个,故B正确;
C、Fe3+是弱碱阳离子,在溶液中会水解导致数目减少,故个数小于0.2NA个,故C错误;
D、甲苯的苯环不是单双键交替的结构,苯环中的键均为介于单双键之间的特殊的键,故1mol甲苯中只含1mol碳碳单键,即0.1mol甲苯只含0.1mol碳碳单键,即0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 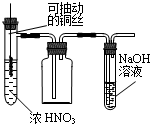 制取少量的NO2 | B. |  电解食盐水制氯气和氢气 | ||
| C. | 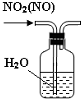 除去NO2中的NO | D. |  用二氧化锰和浓盐酸制氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
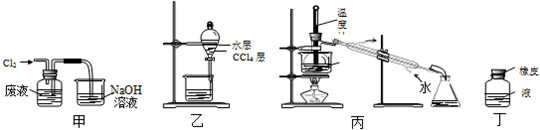
| A. | 用装置甲氧化废液中的溴化氢 | B. | 用装置乙分离CCl4层和水层 | ||
| C. | 用装置丙分离CCl4和液溴 | D. | 用仪器丁长期贮存液溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
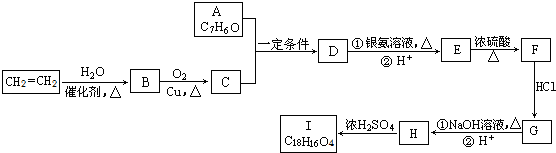
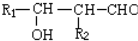
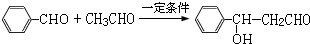 .
.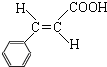 .
. .
.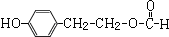
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(g)的浓度与缩小体积前的平衡浓度相等 | |
| B. | 平衡时,单位时间内n(A)消耗:n(C)消耗=1:1 | |
| C. | 若保持体积不变,向平衡体系中加入少量的A,平衡不移动 | |
| D. | 若开始时向容器中加入1 mol B和1 molC,达到平衡时吸收热量Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下遇碘水均会变蓝色 | |
| B. | 一定条件下,它们都能发生水解反应 | |
| C. | 它们的组成都含有C、H、O、N等元素 | |
| D. | 油脂都是高级脂肪酸的甘油酯,是高热营养素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛、铜可以作为多种催化剂的主体.如以TiO2覆盖在Cu2Al2O4表面作催化剂,可以将CO2与CH4直接转化成乙酸.
钛、铜可以作为多种催化剂的主体.如以TiO2覆盖在Cu2Al2O4表面作催化剂,可以将CO2与CH4直接转化成乙酸.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com