
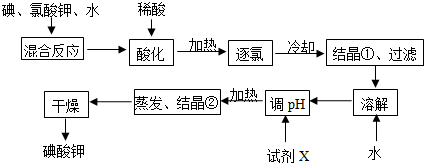
分析 碘、氯酸钾、水混合反应时生成氯化钾、氯气和KH(IO3)2,加入稀硫酸酸化加热赶出氯气,冷却结晶过滤洗涤得到晶体,晶体溶解,加入试剂X为碱调节溶液PH,加热蒸发结晶干燥得到碘化钾,
(1)53号元素I,原子核外有5的电子层,最外层电子数为7,以此确定元素在周期表中的位置;
(2)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低60价,故I2系数为6,根据元素守恒配平KClO3、H2O、KH(IO3)2的系数;
(3)由信息可知,碘酸钾能被氯气氧化,由工艺流程可知酸化的目的是将氯气从反应混合物中逸出,酸性条件下碘酸钾是一种较强的氧化剂,能氧化盐酸,被还原;
(4)加X调节pH时,不能引入杂质,KH(IO3)2与碱反应生成KIO3;
(5)溶液中的氯气与KOH反应生成次氯酸钾,次氯酸钾具有强氧化性.
解答 解:(1)53号元素I,原子核外有5的电子层,最外层电子数为7,则应位于周期表第五周期,第ⅦA族,故答案为:第五周期,第ⅦA族;
(2)I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑,反应中碘元素化合价0价变化为+5价,氯元素化合价+5价变化为-1价和0价,碘、氯酸钾、水混合反应时,若两种还原产物所得电子的数目相同,ClO3-~Cl-~6e-,2ClO3-~Cl2~10e-,电子转移数为30,5ClO3-~5Cl-~30e-,6ClO3-~3Cl2~30e-,则电子转移总数60,得到还原产物物质的量之比为:5KCl~3Cl2,I2~2IO3-~10e-,单质系数为6,KClO3前系数为11,根据碘元素守恒可知KH(IO3)2的系数为6,根据氢元素守恒可知H2O、系数为3,检查氧元素守恒,结合原子守恒配平化学方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,
故答案为:6、11、3、6、5、3;
(3)由信息可知,碘酸钾能被氯气氧化,由工艺流程可知酸化的目的是将氯气从反应混合物中逸出,酸性条件下碘酸钾是一种较强的氧化剂,盐酸能还原已生成的碘酸氢钾,不选用稀盐酸,
故答案为:促进氯气从反应混合物中逸出;稀盐酸;盐酸能还原已生成的碘酸氢钾;
(4)加X调节pH时,不能引入杂质,KH(IO3)2与碱反应生成KIO3,所以要加入KOH,其反应的方程式为:KH(IO3)2+KOH=2KIO3+H2O;
故答案为:KOH;KH(IO3)2+KOH=2KIO3+H2O;
(5)溶液中的氯气与KOH反应生成次氯酸钾,次氯酸钾具有强氧化性,KClO能将KIO3氧化成KIO4从而不能得到碘酸钾;
故答案为:反应产生的氯气跟KOH反应生成KClO,KClO能将KIO3氧化成KIO4从而不能得到碘酸钾.
点评 本题考查了碘酸钾的制备、实验操作评价以及有关计算,该题是高考中的常见题型,属于中等难度的试题,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.


科目:高中化学 来源: 题型:选择题
| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的物质的量比乙的物质的量小 | |
| C. | 气体摩尔体积:甲<乙 | |
| D. | 甲的相对分子质量比乙的相对分子质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
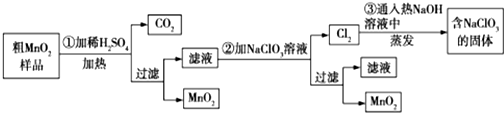
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5 kJ•mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则氢气的燃烧热△H=-571.6 kJ•mol-1 | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)═2H2O2(l)△H1=+108.3 kJ•mol-1 ① N2H4(l)+O2(g)═N2(g)+2H2O(g)△H2=-534.0 kJ•mol-1 ② 则有反应:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-642.3 kJ•mol-1 | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
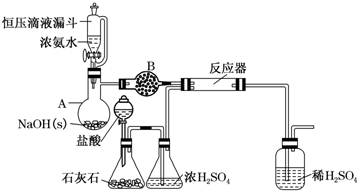
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
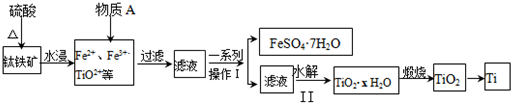
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
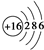 .
. ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com