
| A. | 用容量瓶配制溶液,定容时俯视刻度线所配溶液浓度偏大 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 在电解精炼粗铜的过程中,当转移电子数为NA时,阳极溶解32g | |
| D. | 催化剂通过降低化学反应的焓变加快化学反应速率 |
科目:高中化学 来源: 题型:解答题
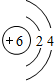 ;X元素基态原子的电子排布式为1s22s22p63s23p5.
;X元素基态原子的电子排布式为1s22s22p63s23p5.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
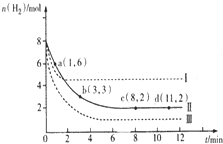 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
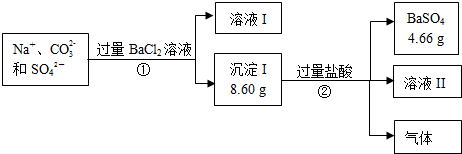
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
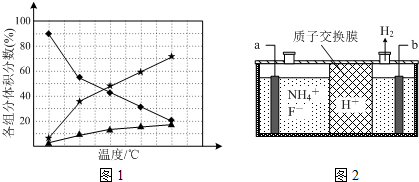
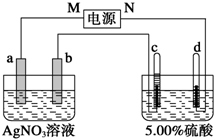 图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答:
图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4HCN(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn(CN)2+(CN)2↑+2H2O | |
| B. | (CN)2+H2O═2H++CN-+CNO- | |
| C. | (CN)2+2OH-═CN-+CNO-+H2O | |
| D. | (CN)2+2SCN-═2CN-+(SCN)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com