
| t/min | 0 | 1 | 3 | 5 | 9 | 10 | 14 |
| X/mol | 1.00 | 0.90 | 0.75 | 0.65 | 0.55 | 0.55 | 0.55 |
| Y/mol | 1.00 | 0.80 | 0.50 | 0.30 | 0.10 | 0.10 | 0.10 |
| Z/mol | 0.00 | 0.20 | 0.50 | 0.70 | 0.90 | 0.90 | 0.90 |
分析 (1)根据物质参与反应的物质的量之比=化学计量数之比;
(2)根据v=$\frac{△c}{△t}$计算;
(3)根据转化率=$\frac{X的转化量}{X的起始量}$×100%、同温同压下,气体的体积分数=气体的物质的量分数.
解答 解:(1)从图表分析,反应1min内X消耗0.1mol,Y消耗0.2mol,Z生成0.2mol,参与反应的X、Y、Z的物质的量之比为:0.1:0.2:0.2=1:1:2,所以化学方程式为:X+2Y?2Z;
故答案为:X+2Y?2Z;
(2)由图,在0~5min内产物Z的生成0.7mol,则v=$\frac{△c}{△t}$=$\frac{0.7mol÷2L}{5min}$=0.07mol/(L•min);
故答案为:0.07mol/(L•min);
(3)分析图表可知反应在9min到达平衡,此时X为0.55mol,Y为0.10mol,Z为0.90mol,则X的转化率为:$\frac{1.00mol-0.55mol}{1.00mol}$×100%=45%;同温同压下,气体的体积分数=气体的物质的量分数,衡混合气体中Z的体积分数为$\frac{0.90mol}{0.55mol+0.10mol+0.90mol}$×100%=58%,
故答案为:45%;58%(或58.1%).
点评 本题考查了根据物质反应量写化学方程式,化学平衡的判断,化学反应的有关计算,题目较基础.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 | |
| B. | 电池的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变,且溶液中有Na2CO3﹒10H2O晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
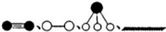 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示: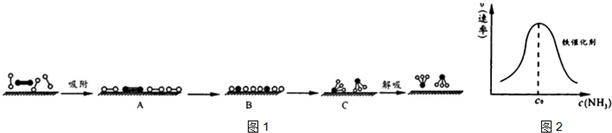
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点 | |
| C. | 上述实验采用相同指示剂,可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
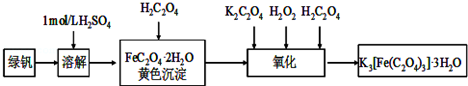
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟离子易与钛离子形成可溶性难电离物质 | |
| B. | 氢氟酸的氧化性比其他酸强 | |
| C. | 氢氟酸的还原性比其他酸强 | |
| D. | 氢氟酸的酸性比其他酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 若起始时向容器中充入0.64 mol C,则达平衡时吸收的热量为0.12a kJ | |
| B. | 恒温,如果压缩容器体积,B的浓度和体积分数均不变 | |
| C. | 若起始时向容器中充入 0.64 mol A 和 0.64 mol B,则达平衡时 n(C)<0.48 mol | |
| D. | 恒温、恒容,向平衡体系中再充入0.32 mol A,再次平衡时,B的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
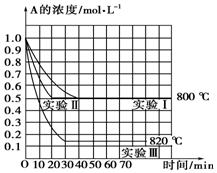 在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答:
在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少量的浓硫酸或浓NaOH沾到皮肤上,应用大量的水反复冲洗,再涂抹相应的药品 | |
| B. | 氢气还原氧化铜,一般先预热氧化铜,然后再通入氢气 | |
| C. | 浓硝酸需用细口棕色试剂瓶密封保存 | |
| D. | 实验室制备有毒气体应在通风橱中进行,且必须对尾气进行吸收或处理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com