
| 1 |
| 2 |
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.4 |

| a |
| 2-a |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 如图所示表示的是电解饱和食盐水的装置,阴极材料是铁棒,阳极材料是碳棒,饱和食盐水中含有少量酚酞.
如图所示表示的是电解饱和食盐水的装置,阴极材料是铁棒,阳极材料是碳棒,饱和食盐水中含有少量酚酞.查看答案和解析>>
科目:高中化学 来源: 题型:
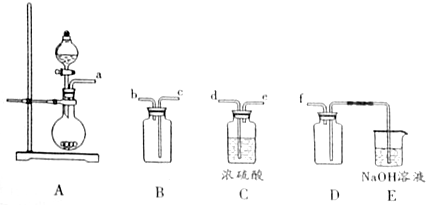
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
| B、浓硫酸沾到皮肤上时,可立即用大量水冲洗,然后涂上3%~5%的NaHCO3溶液 |
| C、酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭水扑灭,不能用水泼灭 |
| D、碱沾到皮肤上时,应立即用大量水冲洗,再涂上硼酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 3 |
| a |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| 反应时间/min | n(NO2)/mol | n(NH3)/mol |
| 0 | 1.20 | 1.60 |
| 2 | 0.80 | |
| 4 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
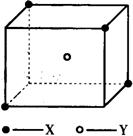 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、Cu2+、SO42- |
| B、NH4+、Na+、NO3-、Cl- |
| C、K+、Ca2+、HCO3-、Cl- |
| D、Mg2+、Na+、Cl-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com