
【题目】为探究同主族非金属元素性质的递变规律,某研究性学习小组的甲同学设计了如图所示的实验装置,其中A装置内可生成Cl2。
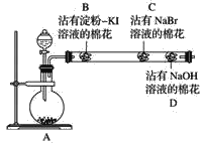
(1)甲同学的部分实验记录如下:B处棉花变成蓝色;C处棉花变成橙红色。甲同学由此现象得出的结论是同主族从上到下元素的非金属性减弱。
①B处发生反应的化学方程式为_________。
②甲同学的结论是________(填“正确”或“不正确”)的,理由是____________________。
(2)乙同学认为应将甲同学实验中B、C两处的棉花调换位置,用氯气先置换出溴,然后溴再与KI接触,以判断Br2与KI能否发生反应。该设想是________(填“合理”或“不合理”)的,原因是___
(3)丙同学在甲同学的实验结束后,取出C处的棉花,将其与另一个沾有淀粉KI溶液的棉花(E)接触,发现E慢慢出现蓝色,结合甲的实验现象,他认为可以确定同主族元素非金属性的递变规律,你同意此种观点吗?______(填“同意”或“不同意”),理由是__________
(4)丁同学综合分析了前面几位同学的实验,认为若将沾有Na2S溶液的棉花置于玻璃管中适当的位置,此实验还可以同时探究同周期元素性质的递变规律,他提出此观点的依据是___,预期的现象与结论是___________,相应反应的离子方程式为_______________。
【答案】Cl2+2KI===I2+2KCl 不正确 该实验没有验证Br2能否与KI反应,无法确定溴与碘元素的非金属性强弱 不合理 氯气不可能被NaBr消耗完,它会与溴一起到达C处 同意 甲、丙的实验分别证明了氯的非金属性比溴、碘强,溴的非金属性比碘强 氯、硫同周期 棉花变成黄色,氯元素的非金属性比硫元素强 S2-+Cl2===2Cl-+S↓
【解析】
本实验目的是探究同主族非金属元素性质的递变规律,实验原理是利用置换反应(氧化剂的氧化性强于氧化产物的氧化性),装置A制备Cl2,B中发生Cl2+2I-=I2+2Cl-,淀粉变蓝,C中发生Cl2+2Br-=Br2+2Cl-,据此分析;
(1)由B、C处产生的现象,可知B处有单质碘生成,C处有单质溴生成,①B处发生反应的化学反应方程式为Cl2+2KI=I2+2KCl;
答案为Cl2+2KI=I2+2KCl;
②结合由强生弱的反应规律可判断出氯的非金属性比溴、碘强,但因没有比较出来溴单质与碘单质氧化性的强弱,也就无法得出溴、碘两种元素非金属性的相对强弱,因此无法得出相应的结论。
答案为不正确;该实验没有验证Br2能否与KI反应,无法确定溴与碘元素的非金属性强弱;
(2)乙同学的设计不合理,氯气与NaBr溶液反应后,未反应Cl2与KI溶液接触而发生反应,因此无法比较出Br的非金属性与I的非金属性强弱;
答案为不合理;氯气不可能被NaBr消耗完,它会与溴一起到达C处;
(3)C处棉花中有液溴,与蘸有淀粉-KI溶液的棉花E后,E慢慢出现蓝色,推出有I2生成,说明Br2将I-氧化成I2,丙同学证明了溴与碘的非金属性强弱关系,结合甲同学的实验可以得出氯、溴、碘三种元素非金属性的相对强弱;
答案为同意;甲、丙的实验分别证明了氯的非金属性比溴、碘强,溴的非金属性比碘强;
(4)硫和氯属于同周期,从左向右非金属性增强,氯能置换出硫,使棉花变成黄色,发生的反应为S2-+Cl2=2Cl-+S↓;
答案为氯、硫同周期;棉花变成黄色,氯元素的非金属性比硫元素强;S2-+Cl2=2Cl-+S↓。


科目:高中化学 来源: 题型:
【题目】某同学为测定一定质量的钠与水反应产生的氢气的体积,设计了图装置进行实验。
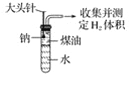
(1)实验开始,欲使钠与水接触反应,应如何操作?______________________________;反应开始后,试管中能观察到的现象是__________________________________________。
(2)已知有关物质的密度ρ(K):0.86 g·cm-3,ρ(Na):0.97 g·cm-3,ρ(煤油):0.8 g·cm-3。如果将钠换成相同大小的钾进行上述实验,结果钾反应完所用时间比钠反应完所用的时间________(填“长”或“短”),其原因是________________________________。
(3)从实验的安全考虑,比较金属钠、钾与水反应的实验操作图A、图B,请指出图B表示哪种金属与水反应____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)分解海水时,________能转变为________能,二氧化钛作________。生成的氢气用于燃料电池时,________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于________反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应如下:
A极:2H2+2O2--4e-=2H2O
B极:O2+4e-=2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的A、B、C、D表示元素周期表中的四个区域:
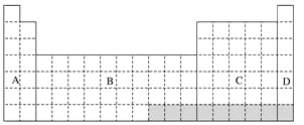
(1)全部是金属元素的区域为____________。
(2)短周期甲元素的单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,甲的原子序数是________。
(3)短周期乙元素的原子核外第三层电子数与第一层电子数相等,则乙元素位于元素周期表的第_______周期第______族。
(4)用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。现有25℃时,浓度均为0.10 mol/L 的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。(已知:Ka(CH3COOH)=1.75×10–5,Kb为CH3COONa的水解常数),下列说法正确的是
A.混合溶液加水稀释,c(OH–)减小
B.25℃时,Ka(CH3COOH)<Kb(CH3COO–)
C.c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
D.向1.0 L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液pH基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧热是指在25℃,101kPa,1mol可燃物完全燃烧生成稳定的化合物时放出的热量。已知热化学方程式:①CO(g)+1/2 O2(g)=CO2(g) ΔH= -283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8kJ·mol-1
则下列说法正确的是
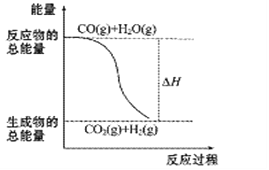
A. H2的燃烧热为241.8 kJ·mol-1
B. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH= -41.2kJ·mol-1
CO2(g)+H2(g) ΔH= -41.2kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要释放能量
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l) ΔH> -241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。
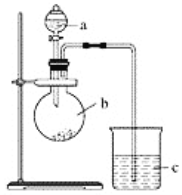
(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)家用液化气的主要成分之一是丁烷(C4H10),当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式___。
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol。请回答下列问题:
①用太阳能分解10mol水消耗的能量是___kJ;
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_____;
③研究NO2、SO2、CO等大气污染气体的处理具有重要意义,已知:
2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ/mol
2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ/mol
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的ΔH=___kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A.常温常压下,9.5g羟基(—18OH)中所含中子数为5NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
C.2molFeBr2与足量氯气反应时,转移的电子数为6NA
D.甲烷燃料电池的正极消耗22.4LO2(标准状况下),电路中通过的电子数为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com