
【题目】已知:2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=﹣1452kJmol﹣1
H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJmol﹣1
下列说法正确的是( )
A.H2(g)的燃烧热为571.6 kJ?mol﹣1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.![]() ?H2SO4(aq)+
?H2SO4(aq)+ ![]() ?Ba(OH)2(aq)=
?Ba(OH)2(aq)= ![]() ?BaSO4(s)+H2O(l)△H=﹣57.3 kJ?mol﹣1
?BaSO4(s)+H2O(l)△H=﹣57.3 kJ?mol﹣1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l)△H=+135.9 kJ?mol﹣1
【答案】B
【解析】解:A.燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物所放出的热量,所以H2的燃烧热为 ![]() ×571.6 KJ/mol,故A错误;
×571.6 KJ/mol,故A错误;
B.令H2(g)和CH3OH(l)的质量都为1g,则1g氢气燃烧放热为 ![]() ×
× ![]() ×571.6=142.45KJ,1gCH3OH燃烧放热为
×571.6=142.45KJ,1gCH3OH燃烧放热为 ![]() ×
× ![]() ×1452=22.68KJ,所以H2(g)放出的热量多,故B正确;
×1452=22.68KJ,所以H2(g)放出的热量多,故B正确;
C.中和热是强酸强碱的稀溶液完全反应生成1mol水时放出的热量,故C错误;
D.2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1改写为3H2(g)+ ![]() O2(g)═3H2O(l)△H=﹣(
O2(g)═3H2O(l)△H=﹣( ![]() ×571.6)kJmol﹣1 ,
×571.6)kJmol﹣1 ,
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=﹣1452kJmol﹣1改写为CO2(g)+2H2O(l)=CH3OH(l)+ ![]() O2(g))△H=+(
O2(g))△H=+( ![]() ×1452)kJmol﹣1 .
×1452)kJmol﹣1 .
改写后的方程相加即得3H2(g)+CO2(g)=CH3OH(l)+H2O(l),所以其△H═﹣( ![]() ×571.6)+(
×571.6)+( ![]() ×1452)=﹣131.4kJmol﹣1 . 故D错误.
×1452)=﹣131.4kJmol﹣1 . 故D错误.
故选B.


科目:高中化学 来源: 题型:
【题目】下列仪器经常用于物质分离的有( )
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥容量瓶 ⑦蒸发皿 ⑧坩埚
A. ①③⑤⑥ B. ①②④⑥ C. ①③⑤⑦ D. ①③⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】珍珠的主要成分是一种钙盐。将其加入稀盐酸中,有气泡产生,生成的气体无气味,而且能使澄清石灰水变浑浊,则珍珠的主要成分是
A. CaCO3 B. CaCl2 C. Ca(OH)2 D. CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2是一种新型的环保饮用水消毒剂,某课题小组拟选择下列部分装置制备并收集二氧化氯来探究其漂白性(装置不可重复使用)。
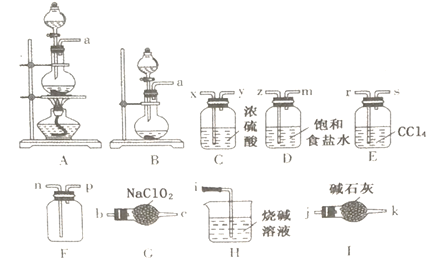
己知:常温下,亚氯酸钠(NaC1O2)可吸收氯气并制备二氧化氯;C1O2是一种易溶于水而难溶于有机溶剂的气体,氧化性比氯气强。
回答下列问题:
(1)制备干燥、纯净的氯气:制备的发生装置是_________ (填代号),//写出反应的离子方程式:__________。
(2)制备二氧化氯:导管口连接顺序为:a→______→n→p→j。本实验选择I而不选择H的原因是:_________________。
(3)写出G中发生反应的化学方程式:___________。
(4)装置E的作用是_____________________________。
(5)他们己收集一瓶二氧化氯气体,请你设计简易实验证明二氧化氯具有永久的漂白性:_________________________________________________________________________________________。
(6)尾气中的二氧化氯还可以用含双氧水的烧碱溶液吸收,其产物之一是NaC1O2。写出该反应的化学方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烷烃A和烯烃Y为原料合成某香料——六元环状酯G、高聚物C和D的流程如下(部分条件和产物省略):

已知:
①Y的核磁共振氢谱有4个峰,其峰面积之比为3:3:2:2
②![]()
回答下列问题:
(1)Y的系统命名为__________;X中含碳官能团名称是________________。
(2)Z→W的反应类型是__________。
(3)聚合物C的结构简式为________________;G的结构简式为__________________。
(4)写出F→D的化学方程式:_________________________________。
(5)E的同分异构体中,含“![]() ”结构的有________种。
”结构的有________种。
(6)参照上述合成路线,设计以![]() 为原料合成
为原料合成![]() 的路线。_____________
的路线。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量干燥的氨气涉及下列装置,其中正确的是
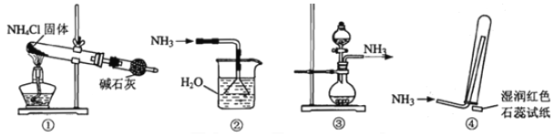
A. ①是氨气发生装置 B. ②是氨气吸收装置
C. ③是氨气发生装置 D. ④是氨气收集、检验装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象与胶体的性质无关的是
A. 将盐卤或石膏加入豆浆,制成豆腐
B. 一枝钢笔使用两种不同型号的蓝黑墨水,易出现堵塞
C. 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D. 清晨,人们经常看到阳光穿过茂密的树木枝叶所产生的美丽“光柱”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的(填仪器名称)的初始读数.
如果液面位置如右图所示,则此时的读数为mL.![]()
(4)滴定.当时,停止滴定,
并记录NaOH溶液的终读数.重复滴定3次.
(5)Ⅱ.实验记录
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
经计算,市售白醋总酸量=g/100mL.
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时距离摇动,有少量液体溅出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是( )
A. ②③ B. ①②③④ C. ①②④ D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com