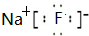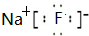(2010?和平区一模)短周期元素a、b、c、d、e、f、g、h的原子序数依次增大,其中a和e、c和g、d和h同主族.b元素的最高正价和最低负价的绝对值之差为2;1mole单质能与冷水反应,在标准状况下生成11.2LH
2;f原子最外层电子数等于其周期序数;h
-的电子层结构与Ar原子相同.
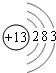
(1)f原子结构示意图为
;d和e形成的化合物电子式为
;
(2)c和f简单离子的半径大小为
O2->Al3+
O2->Al3+
;(用离子符号和“>”、“=”或“<”表示)
(3)元素非金属性强弱比较有很多方法,其中d和h的非金属性强弱的研究方案中不可行的是
①④
①④
(填序号);
①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较与H
2反应的剧烈程度 ④比较最高价氧化物对应水合物的酸性
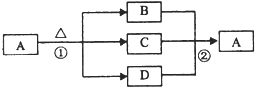
(4)如图是上述部分元素形成的化合物的转化关系图,已知B和D都是具有刺激性气味的气体,B是形成酸雨的污染物之一.
请按要求填空:
①化合物A的化学式
NH4HSO3
NH4HSO3
.
②写出②反应的化学方程式
SO2+NH3+H2O=NH4HSO3
SO2+NH3+H2O=NH4HSO3
.