
| A. | C(Na+)=2C(S2-)+2C(HS-)+2C(H2S) | B. | C(Na+)+C(H+)=C(OH-)+C(HS-)+C(S2-) | ||
| C. | C(OH-)=C(H+)+C(HS-)+2(H2S) | D. | C(Na+)>C(S2-)>C(OH-)>C(HS-) |
分析 A、根据物料守恒分析解答;
B、根据电荷守恒分析解答;
C、根据质子守恒分析解答;
D、Na2S是强碱弱酸盐,硫离子水解导致溶液呈碱性,且硫离子第一步水解程度远远大于第二步水解程度;
解答 解:A、根据物料守恒得c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),故A正确;
B、该物质溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故B错误;
C、根据物料守恒得c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),根据电荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),所以得c(OH-)=c(HS-)+c(H+)+2c(H2S),故C正确;
D、Na2S是强碱弱酸盐,硫离子水解导致溶液呈碱性,且硫离子第一步水解程度远远大于第二步水解程度,硫离子两步水解和水电离都生成氢氧根离子,硫离子第一步水解生成硫氢根离子,所以该溶液中离子浓度大小顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),故D正确;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确盐的类型及水解程度是解本题关键,注意电荷守恒和物料守恒的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:实验题
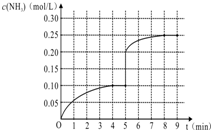 在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:
在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2可用作呼吸面具的供氧剂 | |
| B. | 侯德榜“联合制碱法”制取的是碳酸钠 | |
| C. | 钠与乙醇反应,钠块沉入试管底部 | |
| D. | NaHCO3的热稳定性大于Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是还原产物 | |
| B. | □处对应的物质为H2O | |
| C. | 氧化剂与还原剂物质的量之比为1:8 | |
| D. | 若1mol KMnO4参加反应,转移的电子的物质的量是4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用无磷洗衣粉,以减少水体富营养化 | |
| B. | PM2.5是指大气中直径接近于2.5μm(1m=106μm=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 | |
| C. | 为提高农作物产量大量使用农药和化肥 | |
| D. | 对农作物秸秆进行焚烧还田,以增加土壤肥力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 | |
| B. | 新戊烷的二氯代物有2种 | |
| C. | 分子式为C2H4和C4H8的物质一定互为同系物 | |
| D. | 键线式为 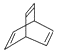 的有机物的分子式为C8H10 的有机物的分子式为C8H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15N中含有7个中子 | |
| B. | N2和N70属于同位素 | |
| C. | N5+中含有36个电子 | |
| D. | 若NH5为离子化合物,则其既含有离子键,又含有共价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com