
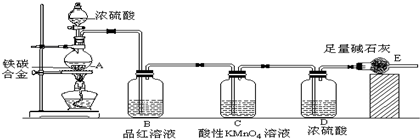
分析 由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下碳与浓硫酸不反应,铁在浓硫酸中发生钝化现象;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水;
(3)A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色;
二氧化硫存在会影响二氧化碳的质量测定,C装置的作用为除尽反应产物中的SO2气体;
(4)E增重b g为二氧化碳的质量,根据碳元素守恒计算合金中碳元素的质量,合金的质量减去碳元素质量等于铁的质量,再根据质量分数定义计算;
(5)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小.
解答 解:由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下,铁与浓硫酸反应生成一层致密的氧化物保护膜,阻止内金属继续与浓硫酸反应,发生钝化现象,
故答案为:常温下Fe遇浓硫酸发生钝化;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色;
C装置的作用为除尽反应产物中的SO2气体,防止影响二氧化碳的质量测定,
故答案为:品红溶液褪色;除尽反应产物中的SO2气体;
(4)E增重b g为二氧化碳的质量,根据碳元素守恒可知合金中碳元素的质量为 $\frac{12}{44}$bg,合金中铁的质量为mg-$\frac{12}{44}$bg=(m-$\frac{3}{11}$b)g,故铁的质量分数 $\frac{m-\frac{3}{11}b}{m}$×10×%=$\frac{11m-3b}{11m}$×100%,
故答案为:$\frac{11m-3b}{11m}$×100%;
(5)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小,铁元素的质量增大,质量分数增大,
故答案为:装置内的CO2难以赶尽,导致E质量增重偏小.
点评 本题考查学生对实验原理的理解、对实验方案与实验装置的评价、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 可通过控制溶液的pH降低氨基酸的熔点,分离不同氨基酸 | |
| B. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| C. | 所有的糖类、油脂和蛋白质均能发生水解反应 | |
| D. | 利用二氧化碳制造全降解塑料能有效减少“白色污染” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
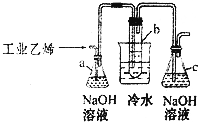 CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br
CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是最内层电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
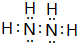 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法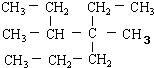 的名称为4,5-二甲基-4-乙基庚烷 的名称为4,5-二甲基-4-乙基庚烷 | |
| B. | 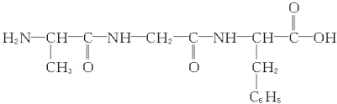 完全水解可以得到3种氨基酸 完全水解可以得到3种氨基酸 | |
| C. | 石油裂解和油脂皂化都是由高分子物质生成小分子物质的过程 | |
| D. | 化合物 的一氯代物有2种 的一氯代物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH和CH3OCH3 | B. | HCOOH和C17H33COOH | ||
| C. | CH3CH2CH2Br和CH3CHBrCH3 | D. |  和 和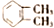 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
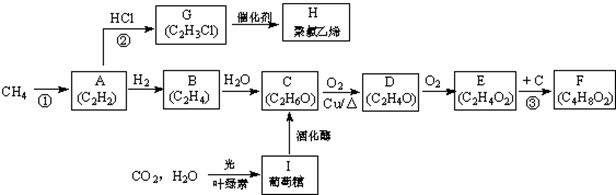
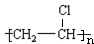
| 共价键 | H-H | C-H | C≡C |
| 能量变化/kJ•mol-1 | 436 | 413 | 812 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| C. | 达到化学平衡时,N2将完全转化为NH3 | |
| D. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com