
| A. | 过量CO2通入溶液中:2NaCN+H2O+CO2=2HCN+Na2CO3 | |
| B. | 经测定CH3COONH4的水溶液呈中性可知:K(NH3•H2O)=1.75×10-5 | |
| C. | 将等物质的量浓度的CH3COONa与NaCN溶液等体积混合后的溶液中:c(CH3COO-)>c(CN-) | |
| D. | 常温下将10ml的PH=3的醋酸溶液稀释到100ml,其PH<4 |
分析 A.电离常数越大,酸性越强,酸性强的可以制酸性弱的;
B.水解程度相同,则电离常数相同;
C.酸越弱,其盐的水解程度越大,酸根离子的浓度越小;
D.弱酸加水稀释10n倍,溶液的pH变化小于n个单位.
解答 解:A.电离常数越大,酸性越强,酸性:H2CO3>HCN>HCO3-,所以过量CO2通入溶液中:NaCN+H2O+CO2=HCN+NaHCO3,故A错误;
B.经测定CH3COONH4的水溶液呈中性,说明铵根离子的水解程度与醋酸根离子的水解程度相同,所以NH3•H2O与醋酸的电离常数相同,即K(NH3•H2O)=1.75×10-5,故B正确;
C.酸越弱,其盐的水解程度越大,酸根离子的浓度越小,酸性:CH3COOH>HCN,水解程度:CH3COO-<CN-,所以c(CH3COO-)>c(CN-),故C正确;
D.醋酸为弱酸,常温下将10ml的PH=3的醋酸溶液稀释到100ml,稀释10倍,则pH变化小于1,即其PH<4,故D正确.
故选A.
点评 本题考查了弱电解质的电离、盐的水解、电离常数的应用,明确酸性强弱与其电离程度、电离常数的关系是解本题关键,难度中等,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:推断题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态水的密度大于冰的密度 | B. | 碘单质和干冰容易升华 | ||
| C. | 氧气的氧化性不如氯气的氧化性 | D. | 溴容易溶于四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 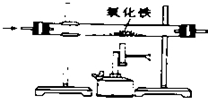 除去CO中的CO2 除去CO中的CO2 | B. | 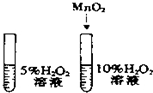 探究二氧化锰对反应速率的影响 探究二氧化锰对反应速率的影响 | ||
| C. | 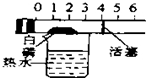 探究空气中氧气的含量 探究空气中氧气的含量 | D. | 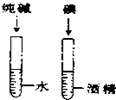 探究溶解性的影响因素 探究溶解性的影响因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
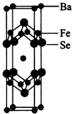 不锈钢是一种常见的合金,耐高温,加工性能好,在生产生活中有广泛用途.一种不锈钢的主要成分是Fe、Ni、Cr、Si、P.回答下列问题:
不锈钢是一种常见的合金,耐高温,加工性能好,在生产生活中有广泛用途.一种不锈钢的主要成分是Fe、Ni、Cr、Si、P.回答下列问题: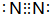 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚不慎沾到皮肤上,要先用氢氧化钠溶液清洗,再用水洗 | |
| B. | 被蜜蜂或者蚂蚁蛰了以后痛痒难忍,可以用稀硼酸溶液清洗被蛰处,可减轻痛痒 | |
| C. | 浓硝酸不慎滴到皮肤上,皮肤变成黄色,是因为发生了颜色反应 | |
| D. | 甘油和乙二醇都可以用做抗冻剂,是因为这两个物质的凝固点比较低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
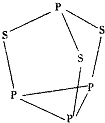 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A元素的一种原子没有中子,只有一个质子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成砖红色(红色)的E2O和EO两种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①⑤⑦⑧ | C. | ①⑤⑥ | D. | ⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
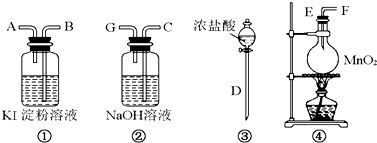
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com