
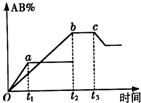
 密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )
密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )| A. | A2、B2、AB均为气体,正反应放热 | |
| B. | AB为气体,A2、B2中最少有一种为非气体,正反应吸热 | |
| C. | AB为气体,A2、B2中最少有一种为非气体,正反应放热 | |
| D. | AB为固体,A2、B2中最少有一种为非气体,正反应吸热 |
分析 由图象可知,升高温度AB的含量减小,说明升高温度平衡向逆反应方向移动,则该反应的正反应为放热反应,从时间t3开始向容器中加压,AB的含量减小,说明平衡向逆反应方向进行,说明反应物气体的化学计量数之和小于生成物化学计量数,则AB为气体,A2、B2中至少有一种为非气体.
解答 解:升高温度AB的含量减小,说明升高温度平衡向逆反应方向移动,则该反应的正反应为放热反应,则△H<0,
从时间t3开始向容器中加压,AB的含量减小,说明平衡向逆反应方向进行,说明反应物气体的化学计量数之和小于生成物化学计量数,则AB为气体,A2、B2中至少有一种为非气体,如都为气体,增大压强平衡不移动,
故选C.
点评 本题考查化学平衡图象问题,题目难度中等,解答本题的关键是根据图象的变化曲线判断温度、越强对平衡移动的影响.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 吉祥物福娃的材质之一是PVC(聚氯乙烯),其单体的结构简式为CH2=CHCl | |
| B. | “祥云”火炬的燃料为丙烷,分子中三个碳原子共面 | |
| C. | 奥运会上使用了锂电池为奥运村、媒体等处服务,这种高能电池的显著特点是提供相同的电量所需的金属正极质量最小 | |
| D. | 奥运“金镶玉”奖牌中的玉的化学成分多为含水钙镁硅酸盐,如Ca2Mg5Si8O22(OH)2,它可用氧化物表示为2CaO•5MgO•8SiO2•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0项 | B. | 1项 | C. | 2项 | D. | 3项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的叙述不正确的是( )
的叙述不正确的是( )| A. | 分子中9个碳原子可能位于同一平面内 | |
| B. | 该物质能使酸性KMnO4溶液褪色 | |
| C. | 1 mol该有机物可与4 mol H2发生加成反应 | |
| D. | 该物质能使溴水褪色是因为该物质将溴从其水溶液中萃取出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2?N2O4 | B. | 2NO2?2NO+O2 | ||
| C. | 2HI?H2+I2 | D. | FeCl3+3KSCN?Fe(SCN)3+3KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(B+)=c(A-)>c(OH-)>c(H+) | B. | c(A-)>c(B+)>c(H+)>c(OH-) | ||
| C. | c(B+)+c(H+)=c(A-)+c(OH-) | D. | c(B+)>c(A-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②>①>③ | B. | ①>②>③ | C. | ③>①>② | D. | ①═②═③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂发生氧化反应 | |
| B. | 当反应中有一种元素被氧化时,一定有另一种元素被还原 | |
| C. | 任何一个置换反应一定属于氧化还原反应 | |
| D. | 氧化还原反应中的反应物,不是氧化剂一定是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com