
【题目】实验发现,298 K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是()。

A.该原电池的正极反应:Zn-2e-=Zn2+
B.左边烧杯中溶液的红色逐渐褪去
C.该电池铂电极上有气泡生成
D.该电池总反应:3Zn+2Fe3+=2Fe+3Zn2+
科目:高中化学 来源: 题型:
【题目】我国某知名企业开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5+xLi![]() LixV2O5。下列说法中正确的是( )
LixV2O5。下列说法中正确的是( )
A.电池在放电时,Li+向负极移动
B.锂在放电时做正极,充电时做阳极
C.该电池充电时阳极的反应为LixV2O5-xe-=V2O5+xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH1=-905.5kJ·mo1—1
4NO(g)+6H2O(g) ΔH1=-905.5kJ·mo1—1
②N2(g)+O2(g) ![]() 2NO(g) △H2
2NO(g) △H2
一定条件下,NO可以与NH3反应转化为无害的物质,反应如下
③NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2Og) ΔH3=—1625.5 kJ·mo1—1
4N2(g)+6H2Og) ΔH3=—1625.5 kJ·mo1—1
下列说法不正确的是
A. 反应③一定能自发进行
B. 反应②生成物总能量高于反应物总能量
C. 反应①使用催化剂,反应速率加快,△H1减小
D. 反应③达到平衡后改变条件,v(正)、v(逆)的变化如图所示,则该条件可能是升高温度
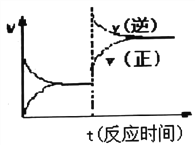
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得H分子的红外光谱如图所示:

又知J为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间的连线表示单键或双键等化学键)。
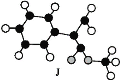
试回答下列问题:
(1)肉桂酸甲酯(H)的结构简式为___。
(2)现测出A的核磁共振氢谱图有6个峰,且面积之比为1∶2∶2∶2∶1∶2。用芳香烃A为原料合成H的路线如下(部分反应物和反应条件已略去) :

①F→G的反应类型是___。
②写出下列反应的化学方程式:F→I:___。
③F的同分异构体较多,其中有一类可用通式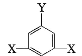 表示(其中X、Y均不为氢原子),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:___。
表示(其中X、Y均不为氢原子),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 4C(g)+2D(g),在不同条件下反应,其平均反应速率v(X)如下,其中反应速率最快的是 ( )
4C(g)+2D(g),在不同条件下反应,其平均反应速率v(X)如下,其中反应速率最快的是 ( )
A.v(A)=0.4mol/(L·s)B.v(B)=0.8mol/(L·s)C.v(C)=1.2mol/(L·s)D.v(D)=0.7mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产、生活中有极其广泛的用途。
(1)化学式Mg17Al12的合金是一种新型的纳米储氢合金,其储氢原来理为Mg17Al12+17H2=17MgH2+12Al,得到的混合物X(17MgH2+12Al)在一定条件下能释放出H2。
①MgH2中氢元素的化合价为____。
②将X与足量的NaOH溶液混合可得到H2,则766gX充分反应后可得到___molH2。
(2)将铝片放在汞盐溶液中,其表面会形成铝汞合金(铝表面的氧化膜被破坏了),从溶液中取出铝并放置在空气中,铝片表面会迅速长出胡须状的“白毛”(主要成分为Al2O3),同时放出大量的热.导致迅速长出“白毛”的原因可能有:一是铝、汞及介质共同形成了微小原电池,加速了铝的氧化反应;二是___。确定前一种可能原因是否存在的简单方法是___。
(3)无水AlCl3可用作有机合成的催化剂,工业上可用Al2O3、Cl2、焦炭混合反应制备无水AlCl3,该反应的另一种产物是可燃性气体,写出该反应的化学方程式:___。
(4)聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,它是应用广泛的高效净水剂。
①PAFC在强酸性和强碱性溶液中均会失去净水作用,原因是____。
②为检测PAFC中Al和Fe的含量,设计如图所示的流程:
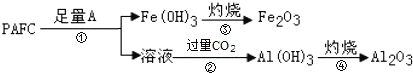
试剂A是____,步骤②中发生反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸式盐NaHB在水溶液中存在下列变化:①NaHB===Na++HB-,②HB-![]() H++B2-,③HB-+H2O
H++B2-,③HB-+H2O![]() H2B+OH-,且溶液中c(B2-)>c(H2B),则下列说法一定正确的是( )
H2B+OH-,且溶液中c(B2-)>c(H2B),则下列说法一定正确的是( )
A. 0.01 mol·L-1的NaHB溶液,其pH可能为2
B. NaHB及H2B均为强电解质
C. 该酸式盐溶液中水电离出的氢离子浓度小于纯水中水电离出的氢离子浓度。
D. HB-的电离程度小于HB-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式:
(1)H2SO4:________________________________________________;
(2)Fe(OH)3:______________________________________________;
(3)NH3·H2O:____________________________________________;
(4)Na2CO3:_______________________________________________;
(5)KHCO3:_______________________________________________。
(6)Al(OH)3的酸式电离:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )
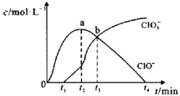
A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.a点溶液中存在如下关系:c(Na+)+c(H+)=c(ClO-)+c(ClO3-)+c(OH-)
C.b点溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2ClO-=Cl-+ClO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com