
分析 ①硫酸钠是可溶性的强电解质,完全电离生成钠离子和硫酸根离子;
②Al 2 O3和NaOH溶液反应生成可溶性的偏铝酸钠和弱电解质水;
③该离子方程式表示强酸或强酸酸式盐和强碱反应生成可溶性的盐和水.
解答 解:①硫酸钠是可溶性的强电解质,完全电离生成钠离子和硫酸根离子,电离方程式为Na2SO4=2Na++SO42-,
故答案为:Na2SO4=2Na++SO42-;
②Al 2 O3和NaOH溶液反应生成可溶性的偏铝酸钠和弱电解质水,离子方程式为Al 2 O3+2OH-=2AlO2-+H2O,
故答案为:Al 2 O3+2OH-=2AlO2-+H2O;
③该离子方程式表示强酸或强酸酸式盐和强碱反应生成可溶性的盐和水,如H2SO4+2NaOH=2H2O+Na2SO4,
故答案为:H2SO4+2NaOH=2H2O+Na2SO4.
点评 本题考查离子方程式和电离方程式的书写,为高频考点,明确电解质的性质、离子方程式书写规则是解本题关键,离子方程式表示一类反应、化学方程式表示一种反应.


科目:高中化学 来源: 题型:选择题
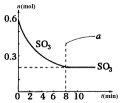 在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )
在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )| A. | 0~8min内v(SO3)=0.025mol/(L•min) | |
| B. | 8min时,v逆(SO2)=2v正 (O2) | |
| C. | 8min时,容器内压强保持不变 | |
| D. | 若8min时将容器压缩为1L,n(SO3)的变化如图中a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
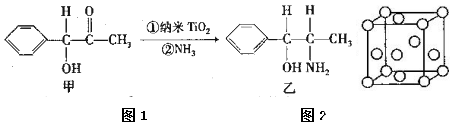
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若ρ(甲)<ρ(乙),则气体的压强:甲>乙 | B. | 若ρ(甲)>ρ(乙),则分子数:甲>乙 | ||
| C. | 若ρ(甲)<ρ(乙),则气体摩尔体积:甲<乙 | D. | 若ρ(甲)>ρ(乙),则气体体积:甲<乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA | |
| B. | 1 molN2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 34g H2O2和H2S混合物中的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃着的酒精灯打翻失火,立即用水浇灭 | |
| B. | 若不慎将浓碱液沾在皮肤上,立即用大量水冲洗,再涂上适量的稀硼酸溶液 | |
| C. | 用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气 | |
| D. | 配制稀硫酸时,可先在量筒中加入一定量的水,再在搅拌下缓慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
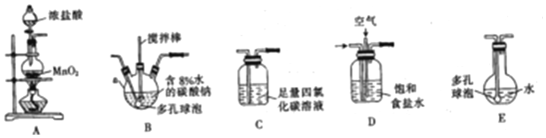
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com