


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
| ③ |
| ④ |
| ⑤ |
| 500℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业.如图是工业上以苯为主要原料,生产龙葵醛的一种合成路线(部分反应条件及副产物已略去):
)是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业.如图是工业上以苯为主要原料,生产龙葵醛的一种合成路线(部分反应条件及副产物已略去):
 ,核磁共振氢谱中有
,核磁共振氢谱中有 .写出以1-丙醇为原料制备三硝酸甘油酯的合成路线流程图(无机试剂任用).
.写出以1-丙醇为原料制备三硝酸甘油酯的合成路线流程图(无机试剂任用).| 500℃ |
| 浓硫酸 |
| 170℃ |
| Br2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 编 号 | ① | ② | ③ | ④ | ⑤ | |
| 试剂 用量 (mL) | 0.20 mol?L-1 (NH4)2S2O8溶液 | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol?L-1 KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol?L-1 Na2S2O3溶液 | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol?L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol?L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间△t(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
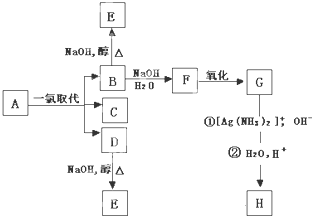
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com