
分析 在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),当达到平衡状态时,测得容器中SO2(g)的转化率为50%,则SO2(g)的浓度变化量为$\frac{2mol}{10L}$×50%=0.1mol/L,则:
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始浓度(mol/L):0.2 0.2 0 0
变化浓度(mol/L):0.1 0.1 0.1 0.1
平衡浓度(mol/L):0.1 0.1 0.1 0.1
(1)再根据K=$\frac{c(S{O}_{3})×c(NO)}{c(S{O}_{2})×c(N{O}_{2})}$计算平衡常数;
(2)该温度下、该容器中,再继续加入1mol的SO2(g),则化学平衡将向正反应方向移动,NO2的转化率将增大.
解答 解:在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),当达到平衡状态时,测得容器中SO2(g)的转化率为50%,则SO2(g)的浓度变化量为$\frac{2mol}{10L}$×50%=0.1mol/L,则:
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始浓度(mol/L):0.2 0.2 0 0
变化浓度(mol/L):0.1 0.1 0.1 0.1
平衡浓度(mol/L):0.1 0.1 0.1 0.1
(1)则平衡常数K=$\frac{c(S{O}_{3})×c(NO)}{c(S{O}_{2})×c(N{O}_{2})}$=$\frac{0.1×0.1}{0.1×0.1}$=1,
故答案为:1;
(2)该温度下、该容器中,再继续加入1mol的SO2(g),则化学平衡将向正反应方向移动,NO2的转化率将增大,故答案为:正反应;增大.
点评 本题考查化学平衡常数计算、化学平衡影响因素,注意化学平衡常数只受温度影响,反应方程式中化学计量数不同,平衡常数表达式也不同,平衡常数单位也不同.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
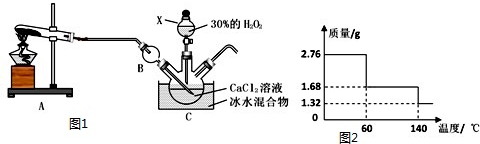
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
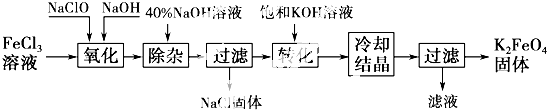
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g•cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上冶炼钠,是通过电解氯化钠饱和溶液 | |
| B. | 工业上冶炼铝,如果以石墨为电极,则阳极石墨需要不断补充 | |
| C. | 工业上冶炼镁,是电解熔融氧化镁 | |
| D. | 工业上精炼铜是粗铜为阴极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com