
【题目】碳酸铜和碱式碳酸铜均可溶于盐酸转化为氯化铜。高温下这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,消耗1mol/L盐酸500mL.灼烧等质量的上述混合物,得到氧化铜的质量是
A. 35g B. 30g C. 20g D. 15g
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】已知NO2与N2O4 可相互转化: 2NO2( g)![]() N2O4(g) △H=24.2 kJ mol1,在恒温下, 将一定量和N2O4的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如图所示。下列推理分析不合理的是
N2O4(g) △H=24.2 kJ mol1,在恒温下, 将一定量和N2O4的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如图所示。下列推理分析不合理的是

A.前10 min内,用v(NO2)表示的反应速率为0. 02 molL1min1
B.反应进行到10 min时,体系吸收的热量为9.68 kJ
C.b、d两点中v(正)与v(逆)均相等
D.25 min时,正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由烃转化为卤代烃的途径较多,下列能得到较纯氯乙烷的方法是
A.乙烷与氯气发生取代反应B.乙烯与氯气发生加成反应
C.乙烯与氯化氢发生加成反应D.乙炔与氯化氢发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示:
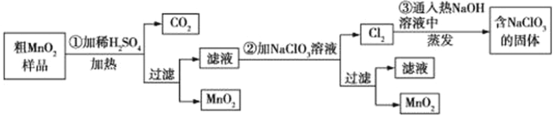
(1)第①步反应中的硫酸能否用浓盐酸代替? (填“能”或“否”),理由是 。
(2)第②步操作中,氧化性强弱顺序:![]() MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式: ;当反应中转移2 mol电子时,生成的氧化产物的物质的量为 mol。
MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式: ;当反应中转移2 mol电子时,生成的氧化产物的物质的量为 mol。
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。
①制取K2MnO4的化学反应方程式为 ,工业上不断搅拌的目的是 。
②电解K2MnO4的浓溶液时,电解的总反应方程式为 。
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000 mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI![]() MnCl2+I2+2KCl+2H2O
MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3![]() 2NaI+Na2S4O6
2NaI+Na2S4O6
取较为纯净的二氧化锰样品a g加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V mL Na2S2O3溶液,则该样品中MnO2含量为 %(杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(17分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:_____。(填元素符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是/span>______,碱性最强的化合物的化学式是:__________。
(3)比较①与⑤的最高价氧化物对应的水化物,_________的酸性强(填化学式);能通过________________________________说明(写反应的化学方程式)。
(4)实验室制取②的氢化物的化学方程式_______________________________ ,②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式为______
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因________________(用化学方程式表示)
(6)比较③与⑥的氢化物,_________ 更稳定(填化学式)
(7)写出④的单质与水反应的离子方程式_______________________。
(8)写出⑦元素的离子结构示意图______,该离子半径_________ S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等。 工业上用NaOH溶液、水合肼制取碘化钠固体,其制备流程图如下:

已知:N2H4·H2O在100℃以上分解。
(1)已知,在合成过程的反应产物中含有NaIO3,则在合成过程中消耗了3 mol I2 ,所生成 NaIO3的物质的量为 mol。
(2)写出还原过程中的离子方程式 ;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过 ℃;请选择下列试剂检测所得碘化钠固体中是否含有NaIO3杂质 (选填字母)。
A.FeCl2溶液 B.冰醋酸 C.KI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000 g 样品、溶解,在250 mL 容量瓶中定容;
b.量取25.00 mL 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000 mol·L 1 的Na2S2O3溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3 +I2![]() Na2S4O6 +2NaI),重复测定2次,所得的相关数据如下表:
Na2S4O6 +2NaI),重复测定2次,所得的相关数据如下表:
测定序号 | 待测液体积/ mL | 标准液滴定管起点读数/ mL | 标准液滴定管终点读数/ mL |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
①操作b中,加入足量的FeCl3溶液时所发生的离子方程式为 。
②加入A物质为 (填名称);滴定终点观察到的现象为 。
③计算该样品中NaI的含量为 。(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016上海]NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×1010)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为____________________(选填“酸性”、“碱性”或“中性”);原因是______________________________。
(2)写出第二次氧化时发生反应的离子方程式:_______________________________________
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___________g(实际用量应为理论值的4倍,才能使NaCN含量低于0.5 mg/L,达到排放标准)。
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________、__________和H2O。
(5)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是___________;H、C、N、O、Na的原子半径从小到大的顺序为_______。
(6)HCN是直线型分子,HCN是___________分子(选填“极性”、“非极性”)。HClO的电子式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com