
| A、c(H+)=c(CH3COO-)+c(OH-) |
| B、加入少量CH3COONa固体后,c(CH3COO-)降低 |
| C、该溶液中由水电离出的c(H+)是1.0×10-11mol/L |
| D、与等体积pH=11的NaOH溶液混合后所得溶液显酸性 |


科目:高中化学 来源: 题型:

| AlCl3 |
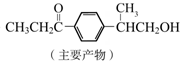 +HCl
+HCl
 与1分子
与1分子  也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铜溶液显酸性:Cu2++2H2O?Cu(OH)2+2H+ |
| B、氯气使湿润的淀粉KI试纸变蓝:Cl2+2I-=2Cl-+I2 |
| C、向硫酸铝溶液中加入氨水出现白色胶状沉淀:Al3++3OH-?Al(OH)3↓ |
| D、实验室不用玻璃塞试剂瓶盛装氢氧化钠溶液:SiO2+2OH-?SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 解释或结论 | |||||
| A | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4 | 溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 | ||||
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了NaHCO3晶体 | ||||
| C | 将Al2(SO4)3溶液蒸干 | 有白色固体生成 | Al3++3H2O
| ||||
| D | 将Na放入CuSO4溶液中 | 有红色固体析出 | 2Na+Cu2+═Cu+2Na+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作及现象 | 结论 |
| A | 将少量浓硫酸滴到蔗糖表面,蔗糖变黑体积膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 葡萄糖与新制Cu(OH)2共热,产生红色沉淀 | 葡萄糖中含有醛基 |
| C | 分别点燃集气瓶中的乙烯和乙炔,乙炔产生的黑烟更浓 | 乙炔的含碳量高于乙烯 |
| D | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18g的D216O中含有的中子数为9NA |
| B、物质的量浓度均为1.0mol/L的硫酸与高氯酸(HClO4)溶液中含有的氧原子数均为4NA |
| C、33.6L NO2溶于足量的水得到的溶液中含有的NO3-数为NA |
| D、32g铜发生氧化还原反应,一定失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | ||
| B、10mol?L-1的浓氨水:Al3+、NH4+、NO3-、I- | ||
| C、0.1 mol?L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl- | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 近年来,碳和碳的化合物在生产生活实际中应用广泛.
近年来,碳和碳的化合物在生产生活实际中应用广泛.| t(℃) | 750 | 850 | 1000 |
| CO% | 0.7 | 2/3 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨工业的核心反应是N2(g)+3H2(g)
合成氨工业的核心反应是N2(g)+3H2(g)| 催化剂 |
| 高温高压 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com