
| A. | 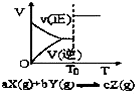 密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 | |
| B. | 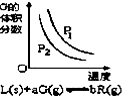 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b | |
| C. | 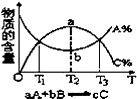 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 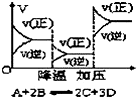 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体 |
分析 A、加催化剂不会引起平衡的移动,反应前后气体系数和不变的反应,改变压强,平衡也不移动;
B、压强不变,升高温度,化学平衡向着吸热方向进行;
C、图象分析可知T2达到平衡,改变条件平衡逆向进行,逆向是吸热反应,正反应为放热反应;
D、图象分析可知,降低温度,速率减小,平衡正向进行,正反应为放热反应,增大压强,速率增大,平衡正向进行,正反应速率大于逆反应速率,说明反应前后调节减小,则D一定为固体或纯液体.
解答 解:A、图象分析可知改变条件,平衡不动,不得条件可能是加入催化剂改变反应速率,不改变化学平衡,或反应前后气体体积不变时,增大压强,速率增大平衡不动,故A错误;
B、图象分析可知,升温G的体积分数减小,说明平衡正向进行,正向是吸热反应,不是放热反应,故B错误;
C、图象分析可知T2达到平衡,改变条件平衡逆向进行,逆向是吸热反应,正反应为放热反应,故C错误;
D、图象分析可知,降低温度,速率减小,平衡正向进行,正反应为放热反应,增大压强,速率增大,平衡正向进行,正反应速率大于逆反应速率,说明反应前后调节减小,则A、B、C是气体,D一定为固体或纯液体,故D正确;
故选D.
点评 本题考查了化学图象分析方法,化学平衡移动原理的应用,主要是条件改变对化学平衡的影响因素分析判断,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 元素相对原子质量依次递增 | |
| B. | 元素的最高正化合价呈周期性变化 | |
| C. | 元素原子最外层电子排布呈周期性变化 | |
| D. | 元素金属性或非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴离子的半径:Z>Y | |
| B. | 气态氢化物稳定性:Z>Y>X | |
| C. | 氧化物的水化物的酸性:Z>Y | |
| D. | 元素W、X、Z各自最高和最低化合价的代数和分别为0、2、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
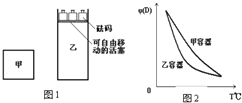 一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )| A. | 甲容器中的反应先达到化学平衡状态 | |
| B. | 两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同 | |
| C. | 两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 | |
| D. | 在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度和乙中物质C的浓度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | W1 | W3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=1.5mol•L-1•min-1 | |
| B. | 2c1<1.5 | |
| C. | 2ρ1=ρ2 | |
| D. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}(3{c}_{1}-1.5)^{3}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷在氯气中燃烧产生大量的白烟,并放出热量 | |
| B. | 纯净的氢气在氯气中安静燃烧,发出黄色火焰 | |
| C. | 光照新制氯水有气泡逸出,该气体是Cl2 | |
| D. | 实验室制备氯气可用排饱和食盐水法收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法计算 | B. | 77.8% | C. | 84.1% | D. | 81.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
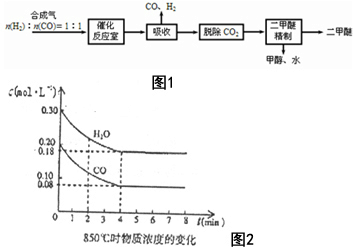 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com