
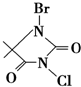
 2013年夏季,南方个别城市遭到暴雨袭击,造成多人伤亡,暴雨过后,对环境进行消毒杀菌、获取洁净的饮用水都需要使用大量消毒剂,开发具有广谱、高效、低毒的杀菌、消毒剂非常重要.
2013年夏季,南方个别城市遭到暴雨袭击,造成多人伤亡,暴雨过后,对环境进行消毒杀菌、获取洁净的饮用水都需要使用大量消毒剂,开发具有广谱、高效、低毒的杀菌、消毒剂非常重要.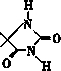 ,
, ;
;

科目:高中化学 来源: 题型:
| A、氨基酸在一定条件下可发生缩聚反应 |
| B、氨基酸具有两性 |
| C、天然蛋白蛋水解的最终产物均为α-氨基酸 |
| D、饱和Na2SO4、CuSO4溶液均可用于蛋白质的盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
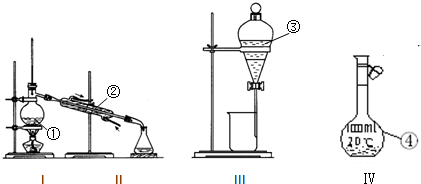
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 请将氧化还原反应2Fe3++2I-?2Fe2++I2设计成带盐桥(无需指明盐桥构成)的原电池.试剂:FeCl3溶液,KI溶液;其它用品任选.请回答下列问题.
请将氧化还原反应2Fe3++2I-?2Fe2++I2设计成带盐桥(无需指明盐桥构成)的原电池.试剂:FeCl3溶液,KI溶液;其它用品任选.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com