
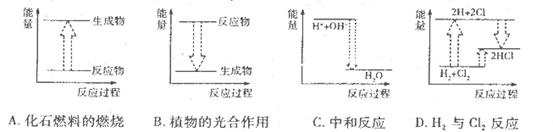
| A£®ČĪŗĪ»Æѧ·“Ó¦¶¼°éĖę×ÅÄÜĮæµÄ±ä»Æ |
| B£®»Æѧ·“Ó¦ÖŠµÄÄÜĮæ±ä»Æ¶¼±ķĻÖĪŖČČĮæµÄ±ä»Æ |
| C£®·“Ó¦ĪļµÄ×ÜÄÜĮæøßÓŚÉś³ÉĪļµÄ×ÜÄÜĮ棬·“Ó¦ŹĶ·ÅÄÜĮæ |
| D£®Čō»Æѧ¼üŠĪ³ÉŹ±ŹĶ·ÅµÄÄÜĮæŠ”ÓŚ¾É»Æѧ¼ü±»ĘĘ»µŹ±ŠčŅŖĪüŹÕµÄÄÜĮ棬·“Ó¦ĪüŹÕÄÜĮæ |



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Ģ¼µÄČ¼ÉÕČČ“óÓŚ110.5kJ/mol |
| B£®·“Ó¦¢Ł·Å³öµÄČČĮæĪŖ221kJ |
| C£®Ļ”ĮņĖįÓėĻ”°±Ė®ČÜŅŗ·“Ó¦µÄÖŠŗĶČČĪŖ£57.3kJ/mol |
| D£®Ļ”“×ĖįÓėĻ”NaOHČÜŅŗ·“Ӧɜ³É1molĖ®£¬·Å³ö57.3kJČČĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
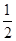 O2(g) ¦¤H£½£266 kJ”¤mol£1
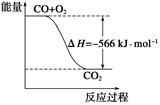
O2(g) ¦¤H£½£266 kJ”¤mol£1| A£®COµÄČ¼ÉÕČČĪŖ283 kJ |
| B£®ĻĀĶ¼æɱķŹ¾ÓÉCOÉś³ÉCO2µÄ·“Ó¦¹ż³ĢŗĶÄÜĮæ¹ŲĻµ |
| C£®2Na2O2(s)£«2CO2(s)===2Na2CO3(s)£«O2(g)””¦¤H>£532kJ”¤mol£1 |
| D£®CO(g)ÓėNa2O2(s)·“Ó¦·Å³ö549 kJČČĮæŹ±£¬µē×Ó×ŖŅĘŹżĪŖ6£®02”Į1023 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
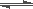 2NH3ĪŖ·ÅČČ·“Ó¦£¬ÓÉ“ĖĶʶĻ³ö £Ø £©
2NH3ĪŖ·ÅČČ·“Ó¦£¬ÓÉ“ĖĶʶĻ³ö £Ø £©| A£®ĒāĘųŗĶµŖĘųŌŚ³£ĪĀ³£Ń¹ĻĀ£¬²»ŠčŅŖČĪŗĪÄÜĮæ¾ĶæÉŅŌŃøĖŁ·¢Éś·“Ó¦ |
| B£®3molĒāĘųŗĶ1molµŖĘųĖł¾ßÓŠµÄ×ÜÄÜĮæµĶÓŚ2mol°±ĘųĖł¾ßÓŠµÄ×ÜÄÜĮæ |
| C£®¶ĻĮŃ1molN”ŌN¼üŗĶ3molH”ŖH¼üĪüŹÕµÄÄÜĮæŠ”ÓŚŠĪ³É6molN”ŖH¼üĖł·Å³öµÄÄÜĮæ |
| D£®ĒāĘųŗĶµŖĘųŹĒøßÄܼ«²»ĪČ¶ØµÄĪļÖŹ£¬°±ĘųŹĒµĶÄÜĒŅ·Ē³£ĪČ¶ØµÄĪļÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®µČĪļÖŹµÄĮæµÄCH4²Ī¼Ó·“Ó¦£¬·“Ó¦¢Ł¢Ś×ŖŅʵĵē×ÓŹżĻąĶ¬ |
| B£®CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)”÷H=£530 kJ/mol |
| C£®0.2 mol CH4»¹ŌNO2ÖĮN2£¬ĒŅÉś³ÉH2O(g)·Å³öµÄČČĮæĪŖ164.6 kJ |
| D£®ČōÓĆ4.48 L(±ź×¼×“æö)CH4»¹ŌNO2ÖĮN2ĒŅÉś³ÉH2O(g)£¬Õūøö¹ż³ĢÖŠ×ŖŅʵē×Ó1.60 mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®¹żŃõ»ÆÄĘÓėĖ®·“Ó¦ | B£®°±Ė®ÓėĻ”ĮņĖįµÄ·“Ó¦ |
| C£®×ĘČȵÄĢæÓėCO2·“Ó¦ | D£®Ba(OH)2”¤8H2OÓėNH4Cl µÄ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com