
下列反应的离子方程式中正确的是( )
A. 钠与水反应:2Na+2H2O=2Na++2OH﹣+H2↑
B. 氢氧化钡溶液和硫酸铵溶液反应:Ba2++SO42﹣=BaSO4↓
C. 硫化钠溶于水呈碱性:S2﹣+2H2O⇌H2S+2OH﹣
D. 向溴化亚铁溶液中通入少量氯气:Cl2+2Br﹣=2Cl﹣+Br2
考点: 离子方程式的书写.
分析: A.钠与水反应生成氢氧化钠和氢气;
B.漏掉了氢氧根离子与氨根离子的反应;
C.硫离子分步水解;
D.氯气少量先氧化二价铁离子.
解答: 解:A.钠与水反应,离子方程式:2Na+2H2O=2Na++2OH﹣+H2↑,故A正确;
B.氢氧化钡溶液和硫酸铵溶液反应,离子方程式:2NH4++2OH﹣+Ba2++SO42﹣=BaSO4↓+2NH3•H2O,故B错误;
C.硫化钠溶于水呈碱性,离子方程式:S2﹣+H2O⇌HS﹣+OH﹣,故C错误;
D.向溴化亚铁溶液中通入少量氯气,离子方程式为::Cl2+2Fe2+=2Cl﹣+2Fe3+,故D错误;
故选:A.
点评: 本题考查了离子方程式的书写,明确反应的实质是解题关键,注意离子还原性强弱规律,注意不能漏掉反应离子,题目难度不大.


科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.向盐酸中滴加氨水:H++OH-=H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
有一固体混合物X,可能含有氯化钠、碳酸钾、亚硝酸钠、硫酸铝、碱式碳酸镁、碳酸氢钠等物质。为探究X的成分,设计方案并进行了如下实验:
Ⅰ.将X粉末充分加热,有气体产生。
Ⅱ.取一定量X粉末,加入足量的蒸馏水,粉末全部溶解,得到无色溶液。
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在火焰上灼烧,产生黄色火焰;透过蓝色钴玻璃观察,无紫色火焰。
Ⅳ.取Ⅱ中无色溶液,滴入KMnO4酸性溶液,紫红色不褪去。
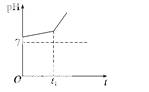
Ⅴ.取Ⅱ中溶液,用惰性电极电解,开始时阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色。电解过程中测得溶液pH变化如右图所示。
(1)根据实验Ⅳ可判断,一定不存在的物质是__________。
(2)X的成分是________(填化学式)。
(3)实验Ⅴ中,0→t1时间内,两个电极上的电极反应式为
阳极:__________ _____________________________________________________;
_____________________________________________________;
阴极:________________ _____________________________________________。
_____________________________________________。
(4)0→t1时间内,溶液pH升高比较缓慢的原因是_______________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.向盐酸中滴加氨水:H+ + OH- = H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C.铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
D.CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜.下面有关解释不正确的是( )
A. 维生素C能将+5价砷氧化成As2O3
B. 维生素C具有还原性
C. 致人中毒过程中+5价砷发生还原反应
D. 青菜中含有维生素C
查看答案和解析>>
科目:高中化学 来源: 题型:
将2a L Al2(SO4)3和(NH4)2SO4的混合物溶液分为两等份,其中一份加入b mol BaCl2,恰好使溶液中的SO42﹣离子完全沉淀;另一份加入足量强碱并加热可得到c mol NH3气,则原混合溶液中的Al3+离子浓度(mol/L)为( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )
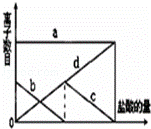
|
| A. | a:Cl﹣b:K+ c:CO32﹣ d:HCO3﹣ |
|
| B. | a:K+ b:CO32﹣ c:Cl﹣ d:HCO3﹣ |
|
| C. | a:K+ b:CO32﹣ c:HCO3﹣ d:Cl﹣ |
|
| D. | a:K+b:HCO3﹣ c:Cl﹣ d:CO32﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是
| 选项 | 目的 | 分离方法 | 原理 |
| A. | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C. | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| D. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com