
分析 (1)分液漏斗在使用前要检验是否漏水;振荡分液漏斗中的液体时,要不时旋开活塞放气,防止分液漏斗内气体压强过大;从分液漏斗向外放液体时,要使漏斗内外气体相通;
(2)CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,其操作为查漏→装液→振荡→静置→分液;
(3)碘在水、四氯化碳中的溶解性不同.
解答 解:(1)分液漏斗在使用前要检验是否漏水,所以要检验分液漏斗活塞和上口的玻璃塞是否漏液;振荡分液漏斗中的液体时,要不时旋开活塞放气,防止分液漏斗内气体压强过大;从分液漏斗向外放液体时,要使漏斗内外气体相通,否则液体难以流下,所以要将漏斗上口玻璃塞打开或使塞上的凹槽或小孔对准漏斗上的小孔,然后旋开活塞,用烧杯接收下层液体;
故答案为:检验分液漏斗活塞和上口的玻璃塞是否漏液;并不时旋开活塞放气;将漏斗上口玻璃塞打开或使塞上的凹槽或小孔对准漏斗上的小孔;
(2)CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液,则步骤为C→B→D→A→H→G→E;
故答案为:C、B、D、A、H、G、E;
(3)CCl4是一种难溶于水的有机溶剂,选用CCl4从碘水中萃取碘的原因是CCl4与水不互溶,而且碘在CCl4中的溶解度比在水中的大得多;
故答案为:CCl4与水不互溶,而且碘在CCl4中的溶解度比在水中的大得多.
点评 本题考查混合物分离提纯,把握物质的性质选择分离、提纯的方法为解答的关键,侧重分离原理及分离实验步骤的考查,题目难度中等,试题有利于培养学生的分析、理解能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
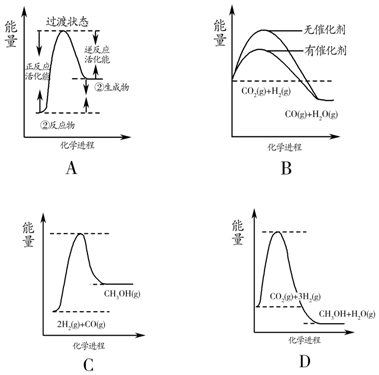
 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H3 | K3 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3 | |
| B. | 硫酸与氢氧化钡反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 氧化铜与稀硫酸反应:2H++O2-═H2O | |
| D. | 碳酸钠溶液中加入盐酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| B. | 光导纤维具有很强的导电能力,应用于制造通信光缆 | |
| C. | 过氧化钠用于呼吸面具中是因为过氧化钠是强氧化剂能氧化CO2和水 | |
| D. | FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能与铜单质发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
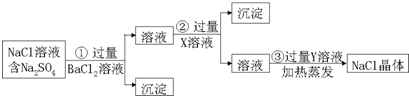
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
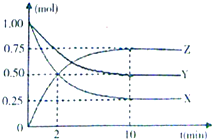 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
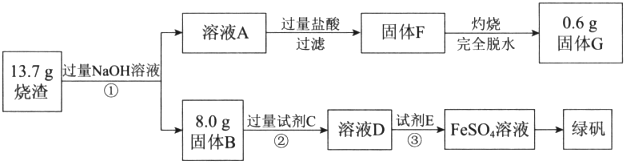
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com