
【题目】在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀。原理简化如图所示。则下列有关说法不正确的是
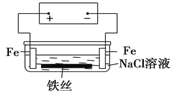
A.原理图可理解为两个串联电解装置
B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色
C.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+
D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等)
【答案】C
【解析】
A、该装置存在外电源,所以是电解池装置,与正极相连的铁为阳极,与负极相连的铁为阴极,而电解质溶液中的铁丝又与铁构成闭合回路,所以该装置可看成是串联的电解池装置,A正确;
B、溶液中铁丝被腐蚀时,左侧的铁与正极相连,为电解池的阳极,失去电子生成亚铁离子,而左侧铁丝与阳极相连,则为阴极,发生还原反应,氢离子放电生成氢气,所以氢氧根离子浓度增大,与亚铁离子结合为白色氢氧化亚铁沉淀,在空气中被氧化,迅速变为灰绿色,B正确;
C、溶液中铁丝的左端是阴极,氢离子放电生成氢气,C错误;
D、地下管线被腐蚀,不易发现,维修也不便,所以为保护地下管线,其表面涂绝缘膜(或油漆等),防止被腐蚀,D正确;
答案选C。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】多相催化反应是在催化剂表面通过吸附、解吸过程进行的。如图,我国学者发现T°C时,甲醇(CH3OH)在铜基催化剂上的反应机理如下:
反应I: CH3OH(g)=CO(g)+2H2 (g) H1=akJ/mol
反应Ⅱ: CO(g)+H2O(g)=CO2 (g)+H2 (g) H2=-bkJ/mol (b>0)
总反应: CH3OH(g)+H2O(g)=CO2 (g)+3H2(g)H3= ckJ/mol

下列有关说法中正确的是( )
A.反应I是放热反应
B.1mol CH3OH(g)和H2O(g)的总能量大于1mol CO2(g)和3mol H2(g)的总能量
C.c>0
D.优良的催化剂降低了反应的活化能,并减少H3,节约了能源。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案,不能达到相应实验目的的是( )
A | B | C | D | |
实验方案 |
|
|
将NO2球浸泡在冷水和热水中 |
|
实验目的 | 探究反应物浓度对化学平衡的影响 | 探究催化剂对反应速率的影响 | 探究温度对化学平衡的影响 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向 0.01 mol·L-1 的醋酸溶液中滴入 pH=7 的醋酸铵溶液,溶液 pH 随滴入醋酸铵溶液体积变化的曲线示意图如图所示。下列分析正确的是
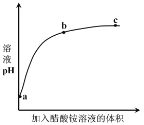
A.a点,pH = 2
B.b点,c(CH3COO-) > c(NH4+)
C.c点,pH可能大于7
D.ac段,pH的增大仅是因为醋酸电离平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
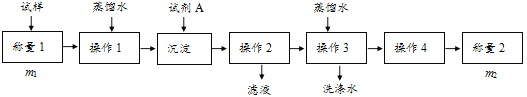
【题目】欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:
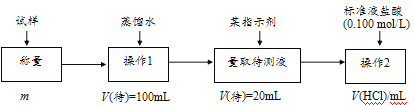
方法二:
方法四:不使用化学试剂,使用实验室常用仪器。
(1)方法一:加入足量的试剂A___(填写A的化学式)可将HCO3-离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、___、洗涤和干燥;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒外,还需要的用到的是___,在操作2中应选择甲基橙指示剂;
(3)在方法二中计算该样品中NaHCO3的质量分数为___[用流程图中的数据m、V(HCl)填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是___;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是___,偏低的原因可能是___(均文字简述);
(6)方法四的实验原理是:___(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(HF)2(g)![]() 2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
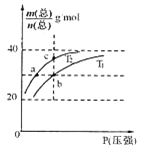
A.温度:T1< T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:v(b)>v(a)
D.当![]() 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息填空
①某元素原子基态核外电子有 14 种不同的运动状态,该元素位于第_____周期第_____族
②外围电子排布式为 3d54s2 的原子,其原子结构示意图为_____,其最高正价为_____价
③Fe2+的价电子排布图为_____
④33 号元素的核外电子排布式简写形式为_____,属于__________区
⑤前四周期未成对电子最多的元素,其基态核外电子占据的轨道数目为_____
⑥《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3 中,阴离子空间构型为_____,C 原子的杂化形式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名导演陈晓卿执导的纪录片《风味人间》中第一集中介绍了一种川西地区的民间美食-灰水煮笋,这里的“灰水”即指加了草木灰的水。草木灰中富含K2CO3(还有少量的KCl和K2SO4),某兴趣小组打算从“灰水”中提取KCl,请你帮他们完成以下工作。
(1)检验“灰水”溶液中的SO42______________________________________________________________________。
(2)检验“灰水”溶液中的CO32。
①小组内有同学认为,往上层澄清溶液中滴入Ca(OH)2溶液观察白色沉淀产生即可证明其中含有CO32。你认为此方案是否正确?__________(填“正确”或“错误”),理由是__________________________________________________________。
②小组内另一同学认为,应往澄清溶液中加入过量稀盐酸,通过______的现象判断CO32-的存在。写出加入过量盐酸反应的离子方程式__________________________。
(3)经过充分讨论后,小组内同学共同设计出了下面的分离提纯路线:

①“混合物1”经过一系列操作最终得到KCl固体,下列操作顺序合理的是______。
a、加入过量K2CO3溶液 B、加入过量稀盐酸 C、过滤 D、蒸发结晶
A、a→b→c→d B、a→c→b→d
C、b→c→a→d D、c→a→b→d
②实验室中,蒸发结晶操作应在___________(填仪器名称)中进行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com