
分析 乙+丁→无色无味气体.说明为Na2CO3、盐酸;依据反应甲+乙→沉淀;乙+丙→沉淀;乙和甲丙反应生成沉淀,丙十丁→沉淀,判断为乙为Na2CO3;丁为盐酸;丙为AgNO3;甲为BaCl2,以此解答该题.
解答 解:乙+丁→无色无味气体.说明为Na2CO3、盐酸;依据反应甲+乙→沉淀;乙+丙→沉淀;乙和甲丙反应生成沉淀,丙十丁→沉淀,判断为乙为Na2CO3;丁为盐酸;丙为AgNO3;甲为BaCl2.
(1)由以上分析可知甲、乙、丙、丁四种溶液依次是BaCl2、Na2CO3、AgNO3、盐酸,故答案为:BaCl2溶液; Na2CO3溶液; AgNO3 溶液;盐酸;
(2)甲和乙的反应为氯化钡和碳酸钠的反应,方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl,丙和丁为硝酸银和盐酸的反应,方程式为AgNO3+HCl=AgCl↓+HNO3,乙和丁反应生成二氧化碳气体,方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O,
故答案为:BaCl2+Na2CO3=BaCO3↓+2NaCl;AgNO3+HCl=AgCl↓+HNO3;Na2CO3+2HCl=2NaCl+CO2↑+H2O.
点评 本题考查物质得到推断和检验,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意要根据物质的性质选择所用试剂,然后由现象得出结论;根据物质的溶解性和反应的条件分析,不仅要把握实验设计的每一个步骤中的实验目的,还要加强记忆鉴别常用离子的方法.


科目:高中化学 来源: 题型:选择题
| A. | 该温度下,反应的平衡常数是$\frac{1}{64}$ | |
| B. | 0~2min内,HI的平均反应速率为0.1mol•L-1•min-1 | |
| C. | 在恒容条件下,向该体系中充入HI气体,平衡不移动,反应速率不变 | |
| D. | 升高温度,平衡向正反应方向移动,只有正反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
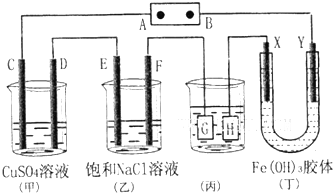
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol SO2(g)和1mol O2(g)具有的能量之和低于2 mol SO3(g)具有的能量 | |
| B. | 将2 mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量 | |
| C. | 升高温度,平衡向逆反应方向移动,上述热化学方程式中的Q值减小 | |
| D. | 将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
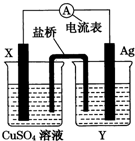 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池,如图所示.请回答下列问题.
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池,如图所示.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=110.5 kJ•mol-1 | |
| B. | C(s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com