

| A、该有机物的分子式是C15H27O4N4 |
| B、该分子中含有氨基、羧基、羟基、醛基等官能团 |
| C、该分子不仅具有两性,还能发生水解反应和酯化反应 |
| D、该分子中含有5个手性碳原子 |
 ,共5个手性C原子,故D正确.
,共5个手性C原子,故D正确.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
| A、碘是人体必需的微量元素,所以要多吃富含I2的食物 |
| B、金属钠、钾、锂保存在煤油中 |
| C、碳酸钠溶液用带磨口玻璃塞的普通试剂瓶贮存 |
| D、量筒、容量瓶、滴定管上均标有温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol/L |
| B、0.5 mol/L |
| C、0.15 mol/L |
| D、0.25 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | H2C2O4溶液 | KMnO4溶液 | 硫酸溶液 | 温度/℃ | ||
| 浓度 (mol/L) | 体积 (mL) | 浓度 (mol/L) | 体积 (mL) | |||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:3 | B、3:4 |
| C、9:8 | D、9:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、6 | D、9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z | W |
| 初始浓度/mol?L-1 | 1.0 | 2.0 | 0 | 0 |
| 平衡浓度/mol?L-1 | 0..4 | 0.2 | 1.2 | 0.6 |
| A、反应达到平衡时,Y的转化率为90% |
| B、反应可表示为X(g)+3Y(g)═2Z(g)+W(g),其平衡常数为270 L?mol-1 |
| C、增大压强平衡向正反应方向移动,平衡常数不变 |
| D、改变温度或向平衡体系中加入X都会使平衡移动,平衡常数也会随之改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
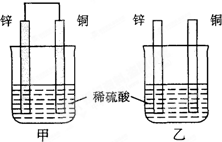 将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com