
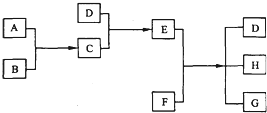
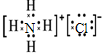
分析 由“D+C→E,且C、D为气体;E为固体”可推知C、D可能为NH3、HCl;E为NH4Cl,再结合“E+F→D+H+G,G是氯化钙”进一步推知D为NH3、F为Ca(OH)2,H为水,所以C是HCl,A、B分别是H2和Cl2,以此解答该题.
解答 解:由“D+C→E,且C、D为气体;E为固体”可推知C、D可能为NH3、HCl;E为NH4Cl,再结合“E+F→D+H+G,G是氯化钙”进一步推知D为NH3、F为Ca(OH)2,H为水,所以C是HCl,A、B分别是H2和Cl2,
(1)由以上分析可知,D的化学式是NH3;E的化学式是NH4Cl,氯化铵为离子化合物,氯离子中的最外层电子应该标出,正确的电子式为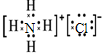 ,
,
故答案为:NH3;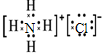 ;
;
(2)C、D为NH3、HCl,C和D反应的化学方程式是NH3+HCl=NH4Cl,可观察到有白烟生成,
故答案为:有白烟生成;
(3)氯化铵和氢氧化钙反应生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)D为氨气,工业上用氮气与氢气反应生成氨气,反应的化学方程式为:N2+3H2$?_{催化剂}^{高温高压}$2NH3,
故答案为:N2+3H2$?_{催化剂}^{高温高压}$2NH3.
点评 本题考查无机物的推断,侧重NH3的实验室制法,NH3、HCl的性质等知识的考查,注意把握常见反应的特点,难度不大,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和丙烷 | B. | 甲烷和丙烷 | C. | 甲烷和丙烯 | D. | 乙烯和丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
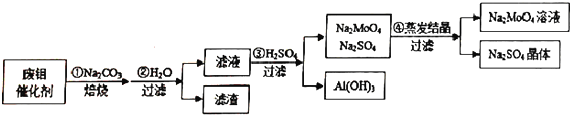
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ②④⑤⑥ | C. | ②⑤ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中所有金属都以化合态形式存在 | |
| B. | 化学史上,金、银、铜发现较早,钾、钠、铝发现较迟是因为前者自然界含量高,后者含量低 | |
| C. | 废旧金属处理的最好办法是深埋 | |
| D. | 冶炼金属的一般步骤是:浮选富集→冶炼→精炼 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 物质的量浓度为1mol/L100mlHCl溶液中含0.1molHCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: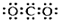 | B. | Na+的结构示意图: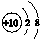 | ||
| C. | 氯离子:Cl | D. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com