
【题目】高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾在异丙醇中溶解度非常小。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
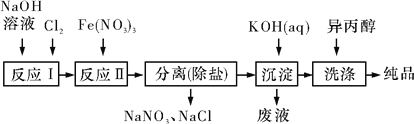
①洗涤粗品时选用异丙醇而不用水的理由是__________________________________。
②反应Ⅱ的离子方程式为__________________________________________________。
③已知25 ℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=_______ 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,析出后溶液中c(K+)<c(Na+)。由以上信息可知______(填字母)。
A.高铁酸钾的溶解度比高铁酸钠大 B.Ksp(K2FeO4)<Ksp(Na2FeO4)
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为__________________。
(4) 锌-锰碱性电池以KOH溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s)。
Zn--K2FeO4 也可以组成碱性电池,与 Zn--MnO2电池类似。K2FeO4在电池中作正极材料,其电极反应式为__________________________________________________________,该电池总反应的离子方程式为___________________________________________________。
【答案】 减少高铁酸钾的溶解损失 3ClO-+10OH-+2Fe3+===2FeO42-+3Cl-+5H2O 3 B 3∶1 FeO42-+3e-+4H2O===Fe(OH)3+5OH- 2FeO42-+8H2O+3Zn===2Fe(OH)3+3Zn(OH)2+4OH-
【解析】试题分析:本题以高铁酸钾的制备为载体,考查离子方程式的书写,氧化还原反应的计算,溶度积的计算及应用,原电池的工作原理。
(1)①因为高铁酸钾在异丙醇中溶解度非常小,洗涤粗品时选用异丙醇而不用水可减少高铁酸钾的溶解损失。
②根据流程,反应I为Cl2+2NaOH=NaCl+NaClO+H2O,根据湿法制备高铁酸钾的反应原理,反应II为NaClO与Fe(NO3)3在碱性介质中生成紫红色的高铁酸钠,Fe3+被氧化成FeO42-,ClO-被还原成Cl-,反应可写成:ClO-+Fe3+→Cl-+FeO42-,Cl元素的化合价由+1价降至-1价,Fe元素的化合价由+3价升至+6价,根据元素化合价升降总数相等配平:3ClO-+2Fe3+→3Cl-+2FeO42-,结合溶液呈碱性、原子守恒、电荷守恒,写出离子方程式为3ClO-+2Fe3++10OH-=3Cl-+2FeO42-+5H2O。
③要开始产生沉淀,离子积要达到Ksp,K sp=c(Fe3+)·c3(OH-)=4.0![]() 10-38,c(OH-)=
10-38,c(OH-)=![]() =1
=1![]() 10-11mol/L,则c(H+)=1
10-11mol/L,则c(H+)=1![]() 10-3mol/L,pH=-lg c(H+)=3。
10-3mol/L,pH=-lg c(H+)=3。
(2)湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,析出后溶液中c(K+)<c(Na+),说明高铁酸钾的溶解度比高铁酸钠小,Ksp(K2FeO4)<Ksp(Na2FeO4),答案选B。
(3)干法制备K2FeO4的原理为:Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物;反应中Fe元素的化合价由Fe2O3中的+3价升高到高铁酸钾中的+6价,Fe2O3为还原剂;N元素的化合价由KNO3中的+5价降至KNO2中的+3价,KNO3为氧化剂;根据得失电子守恒,反应中氧化剂与还原剂的物质的量之比为3:1。
(4)K2FeO4在电池中作正极材料,在碱性电解液中,FeO42-被还原成Fe(OH)3,正极电极反应为FeO42-+3e-→Fe(OH)3,结合电解液呈碱性、原子守恒、电荷守恒,正极电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-。Zn—K2FeO4 组成的碱性电池,与 Zn—MnO2电池类似,负极电极反应式为:Zn-2e-+2OH-=Zn(OH)2,将正极电极反应式和负极电极反应式相加消去电子得该电池总反应的离子方程式为2FeO42-+8H2O+3Zn=2Fe(OH)3+3Zn(OH)2+4OH-。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】一定量的Fe与过量的稀硫酸反应制取氢气,一定温度下为加快反应速率而又不影响氢气的量,可向其中加入少量
A. SO3固体
B. Zn粉
C. K2SO4固体
D. CuSO4晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有8种物质:①甲烷;②苯;③聚乙烯;④苯乙烯;⑤丁炔;⑥环己烷;⑦邻二甲苯;⑧环己烯。既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
A. ③④⑤⑧ B. ④⑤⑧ C. ④⑤⑦⑧ D. ③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,已知KSp(AgCl)=1.8×10-10,将2×10-5mol/L的AgNO3溶液和2×10-5mol/L的KCl溶液等体积混合,下列说法正确的是( )
A. 恰好形成AgCl饱和溶液 B. 能析出AgCl沉淀
C. 不能析出AgCl沉淀 D. 无法确定能否析出AgCl沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com