
分析 Na2CO3、CuCl2、Na2SiO3、NaCl中某几种物质的混合物,混合物能溶于水并得无色透明溶液,说明溶于水有颜色的物质不能有;向溶液中加入过量盐酸,产生无色气体和沉淀.再加入过量的NaOH溶液,沉淀全部消失,据此分析出含有Na2CO3和Na2SiO3.
解答 解:Na2CO3、CuCl2、Na2SiO3、NaCl中某几种物质的混合物.
①混合物能溶于水并得无色透明溶液,由于CuCl2溶于水后溶液显蓝色,故CuCl2不能有;
②向溶液中加入过量盐酸,产生无色气体和沉淀.能和盐酸生成气体的为Na2CO3,能和盐酸生成沉淀的为Na2SiO3,生成的沉淀为H2SiO3,再加入过量的NaOH溶液,H2SiO3和氢氧化钠反应生成可溶性硅酸钠,沉淀消失,故混合物中一定含有Na2CO3和Na2SiO3.
从而可知,NaCl的存在不能确定.
故一定含有的是Na2CO3和Na2SiO3,一定没有的是CuCl2,不能确定的是NaCl.
故答案为:Na2CO3和Na2SiO3;CuCl2;NaCl.
点评 本题考查了物质检验的方法和应用,关键是依据实验现象做出判断,难度不大,属于物质的推断中较简单的一类题目.


科目:高中化学 来源: 题型:选择题
| A. | 氯化物 | B. | 合金 | C. | 硫化物 | D. | 氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别是ⅣA和IA族 | B. | 分别是VIA族和IA族 | ||
| C. | 分别是ⅣA和ⅢB族 | D. | 分别是ⅣA族和ⅢB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
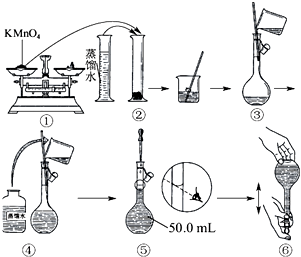 人体血液里Ca2+的浓度一般采用mg/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度.
人体血液里Ca2+的浓度一般采用mg/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有反应物和产物中都既含极性键又含非极性键 | |
| B. | 消耗22.4L CO2可制得乙酸60g | |
| C. | 该反应不是氧化还原反应 | |
| D. | 该反应过程符合“绿色化学”原理,原子利用率达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(aq)+HNO3(aq)═NaNO3(aq)+H2O(l)△H=+57.3kJ/mol(中和热) | |
| B. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ/mol(燃烧热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8kJ/mol(反应热) | |
| D. | 2NO2═O2+2NO△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com