
| A.①③⑤ | B.①②③ | C.④⑤⑥ | D.①②③⑤ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题
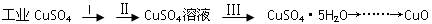
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
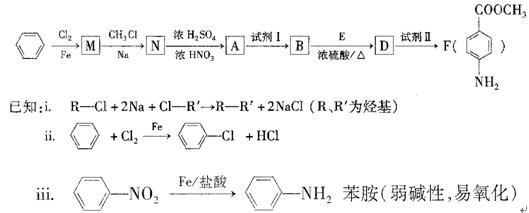
 符合下列要求的两种D的同分异构体的结构简式一。
符合下列要求的两种D的同分异构体的结构简式一。 结构。
结构。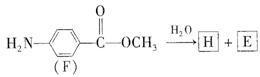
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.容器内气体压强保持不变 |
| B.容器内各物质的浓度不随时间变化 |
| C.当υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1时 |
| D.1个N≡N键断裂的同时,有3个H-H键形成 |
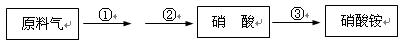
 4HNO3,原料气为氨气和空气的混合物。
4HNO3,原料气为氨气和空气的混合物。查看答案和解析>>
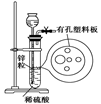
科目:高中化学 来源:不详 题型:实验题
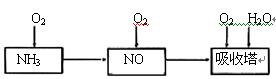
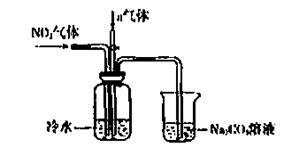
 (6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K= 。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K= 。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制0.1 mol·L-1 100 mL的CuSO4溶液 |
| B.蒸发 |
| C.测定硫酸铜晶体中结晶水的含量 |
| D.萃取、分液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.对装置甲,双手移去后,导管中水面与烧杯水面相平,则说明装置不漏气 |
| B.装置乙用于实验室制取Cl2 |
| C.从海带中提取碘的实验过程中,用丙图装置向烧杯中放出碘的苯溶液 |
| D.丁图装置可用于实验室收集甲烷气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com