
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法中正确的是( )
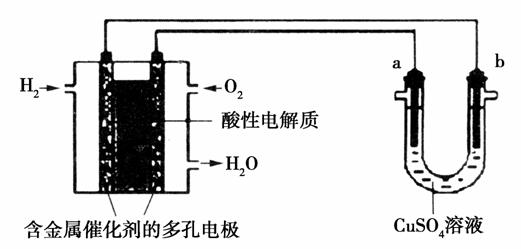
A.燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
两种气态烃的混合物共1 L,在空气中完全燃烧得到1.5 L CO2和2 L水蒸气(体积均在同温同压下测定),关于此混合烃的判断正确的是 ( )
A.肯定是甲烷和乙烯的混合物 B.一定不是甲烷和乙烯的混合物
C.一定含乙烯,不含甲烷 D.两种烃分子中氢原子数都是4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机化合物的结构、性质的叙述正确的是( )
A.苯、油脂均能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体
D.乙醇、乙酸均能与NaOH溶液反应,因为分子中均含有官能团“—OH”
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是( )

A.电池放电时Na+从a极区移向b极区
B.每消耗3 mol H2O2,转移的电子为3 mol
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为BH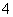 +2H2O-8e-===BO
+2H2O-8e-===BO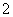 +8H+
+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)
ΔH=-1367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
ΔH=+57.3 kJ·mol-1(中和热)
C.2NO2===O2+2NO
ΔH=+116.2 kJ·mol-1(反应热)
D.S(s)+O2(g)===SO2(g)
ΔH=-296.8 kJ·mol-1(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.某兴趣小组用如图装置做了两次实验。
实验①:向甲池的Pt电极表面通氢气,发现电流计指针发生了偏转,乙池的Pt电极表面出现气泡。
实验②:向乙池的Pt电极表面通氧气,发现电流计指针也发生了偏转,且偏转方向与实验①相同,同时甲池的Pt电极表面也出现气泡。
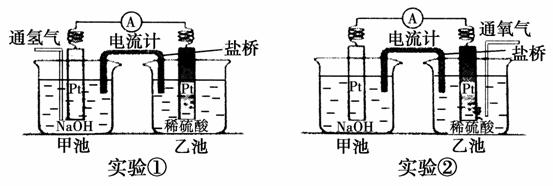
(1)实验①,甲池通氢气的Pt电极为________________极,电极反应式为_________________________________________________。
(2)实验②,乙池通氧气的Pt电极为________________极,电极反应式为__________________________________________________。
(3)两次实验中原电池的总反应相同,总反应的离子方程式为___
__________________________________________________________。

Ⅱ.电解法污水处理技术已很成熟。富含悬浮物的工业污水采用如图装置进行处理:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,吸附部分悬浮物沉降,同时阴极产生的气泡将部分悬浮物带到水面形成浮渣层,然后滤去沉淀、撇掉浮渣层。富含有机废物的生活污水也可用同样方法进行处理。污水中的有机废物能被阳极的某一产物迅速降解成二氧化碳、水等无机物。
(1)在电解处理过程中,若污水中离子浓度较小,导电能力较差,处理效率下降,此时可向污水中加入适量的________。
a.BaSO4 b.CH3COOH
c.NaNO3 d.CH3OH
(2)电解处理过程中,阳极实际发生了两个电极反应,阳极的电极反应式分别是①________________;②________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应X(g)+Y(g)nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
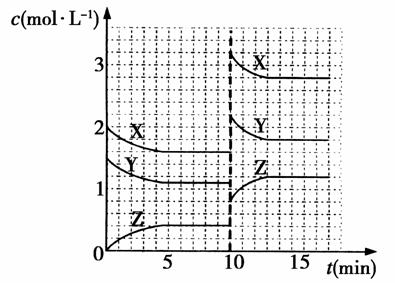
A.反应方程式中n=1
B.10 min时,曲线发生变化的原因是升高温度
C. 10 min时,曲线发生变化的原因是增大压强
D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
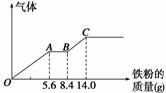 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。
向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是 ( )
A.原混合酸中NO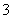 物质的量为0.1 mol
物质的量为0.1 mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为2.5 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com