
分析 (1)设出氧气的物质的量,然后根据差量法及压强关系列式计算出达到平衡时消耗氧气的物质的量,然后计算出用O2的浓度变化来表示反应的化学反应速率;
(2)计算出反应消耗的二氧化硫的物质的量,再根据转化率的表达式计算出二氧化硫的转化率;
(3)计算出达到平衡时各组分的浓度,然后根据平衡常数的表达式计算出该温度下该反应的平衡常数.
解答 解:设达到平衡时消耗氧气的物质的量为x,
则:2SO2(g)+O2(g)?2SO3(g)△n
2 1 2 1
x x
达到平衡时气体的总物质的量为:4mol+4mol-x=8mol-x,
压强和物质的量成正比,则:$\frac{8mol-x}{8mol}$=80%,
解得:x=1.6mol,
(1)达到平衡时消耗氧气的物质的量为1.6mol,用O2的浓度变化来表示反应的化学反应速率为:v(O2)=$\frac{\frac{1.6mol}{2L}}{5min}$=0.16mol/(L•min),
答:用O2的浓度变化来表示反应的化学反应速率为0.16mol/(L•min);
(2)二氧化硫的转化率为:$\frac{3.2mol}{4mol}$×100%=80%,
答:SO2的转化率为80%;
(3)达到平衡时,各组分的浓度为:c(SO2)=$\frac{4mol-1.6mol×2}{2L}$=0.4mol/L,c(O2)=$\frac{4mol-1.6mol}{2L}$=1.2mol/L,c(SO3)=$\frac{3.2mol}{2L}$=1.6mol/L,
该温度下该反应的平衡常数为:K=$\frac{1.{6}^{2}}{0.{4}^{2}×1.2}$=$\frac{40}{3}$=13.3,
答:该温度下该反应的平衡常数为13.3.
点评 本题考查了化学反应速率、化学平衡常数、转化率等计算,题目难度中等,注意掌握化学反应速率、化学平衡常数的概念及计算方法,明确密闭容器中物质的量与压强成正比的关系.


科目:高中化学 来源: 题型:选择题
| A. | Al3+、S2-、Na+、Cl- | B. | K+、Fe3+、S2-、OH- | ||
| C. | Ba2+、HCO3-、Fe3+、H+ | D. | Na+、Al3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 鉴别方法 | Fe2+ | Fe3+ |
| 直接观察色 | 浅绿色 | 棕黄色 |
| 与KSCN溶液 | 无现象 | 血红色 |
| 金属 | Ti | Mg | Cu |
| 金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有氧化性,都是氧化性酸 | |
| C. | HF、HClO、NH3都易溶于水,都是电解质 | |
| D. | C2H2、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 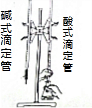 用HF标准溶液测定未知浓度的NaOH溶液 用HF标准溶液测定未知浓度的NaOH溶液 | |
| B. | 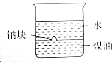 验证密度:ρ(水)<ρ(钠)<ρ(煤油) 验证密度:ρ(水)<ρ(钠)<ρ(煤油) | |
| C. | 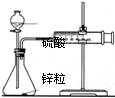 测定锌与硫酸反应的速率 测定锌与硫酸反应的速率 | |
| D. | 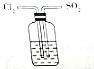 验证SO2和Cl2等物质的量混合增强漂白效果 验证SO2和Cl2等物质的量混合增强漂白效果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com