
A.Zn>Fe>Na>Mg>Al B.Al>Mg>Na>Fe>Zn
C.Na>Mg>Al>Fe>Zn D.Fe>Zn>Mg>Al>Na
解析:本题有以下3种解法。
方法一(设“一”法):设分别取Na、Mg、Al、Zn、Fe各1 g放入足量稀盐酸中。则:
(1)2Na+2H+![]() 2Na++H2↑
2Na++H2↑
46 g 2 g
1 g ![]() g
g
(2)Mg+2H+![]() Mg2++H2↑
Mg2++H2↑
24 g 2 g
1 g ![]() g
g
(3)2Al+6H+![]() 2Al3++3H2↑
2Al3++3H2↑
54 g 6 g
1 g ![]() g
g
(4)Zn+2H+![]() Zn2++H2↑
Zn2++H2↑
65 g 2 g
1 g ![]() g
g
(5)Fe+2H+![]() Fe2++H2↑
Fe2++H2↑
56 g 2 g
1 g ![]() g
g
比较数的大小顺序便可得到答案。
方法二(排除法):在方法一中只进行前三种计算,便知答案。
方法三(摩尔电子质量法):对方法一进行总结,可以发现以下规律:
等质量金属与足量酸反应,金属的相对原子质量与反应后金属化合价的比值(即![]() ,n为反应后金属的化合价)越小,生成H2越多;反应中,转移1 mol电子,需要金属的质量越小,等质量金属与酸反应生成H2越多。
,n为反应后金属的化合价)越小,生成H2越多;反应中,转移1 mol电子,需要金属的质量越小,等质量金属与酸反应生成H2越多。
答案:B


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
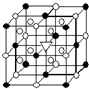 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| bNA |
| a |
| bNA |
| a |
| 1000a |
| MV |
| 1000a |
| MV |
| 100a |
| ρV |
| 100a |
| ρV |
查看答案和解析>>
科目:高中化学 来源: 题型:
| m |
| M |
| m |
| M |
| 4mNA |
| M |
| 4mNA |
| M |
| 22.4m |
| M |
| 22.4m |
| M |
| 100m |
| (1000+m) |
| 100m |
| (1000+m) |
| m |
| MV |
| m |
| MV |
| m |
| 2MV |
| m |
| 2MV |
| 4m |
| M |
| 4m |
| M |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省卧龙学校高一上学期期中模块检测化学试卷 题型:填空题
(13分)现有某XY3气体m g,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为
(2)该气体所含原子总数为 个
(3)该气体在标准状况下的 体积为
体积为
(4)该气体 溶于1L水中(不考虑反应)
溶于1L水中(不考虑反应) ,其溶液中溶质的质量分数为
,其溶液中溶质的质量分数为
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为 ;
将该溶液加水稀释至原体积的2倍后,再取出50mL稀释后的溶液,则取出溶液的物质的量浓度为
(6)标准状况下,相同体积的另一种气体CH4含有氢原子的物质的量为
查看答案和解析>>
科目:高中化学 来源:2014届山东省卧龙学校高一上学期期中模块检测化学试卷 题型:填空题
(13分)现有某XY3气体m g ,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为
(2)该气体所含原子总数为 个
(3)该气体在标准状况下的体积为
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为 ;
将该溶液加水稀释至原体积的2倍后,再取出50mL稀释后的溶液,则取出溶液的物质的量浓度为
(6)标准状况下,相同体积的另一种气体CH4含有氢原子的物质的量为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com