
【题目】乙二醇(沸点:197.3℃)是一种重要的的基础化工原料。由煤基合成气(主要成分CO、H2)与氧气先制备得到草酸二甲酯(沸点:164.5℃),再加氢间接合成乙二醇,具有反应条件温和、环境污染小等优点。反应过程如下:
反应 I:4NO(g)+ 4CH3OH (g)+ O2 (g)![]() 4CH3ONO(g)+ 2H2O(g) △H1=a kJ·mol-1
4CH3ONO(g)+ 2H2O(g) △H1=a kJ·mol-1
反应 II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=bkJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=bkJ·mol-1
反应III:CH3OOCCOOCH3 (1)+ 4H2(g)![]() HOCH2CH2OH(1)+ 2CH3OH (g) △H3=ckJ·mol-1
HOCH2CH2OH(1)+ 2CH3OH (g) △H3=ckJ·mol-1
(1)煤基合成气间接合成乙二醇的总热化学方程式是_________,在较低温条件下,该反应能自发进行的可能原因是_________。
(2)CO、CH3ONO各0.4mol在恒温、容积恒定为2L的密闭容器中发生反应II,达到平衡时NO的体积分数33.3%,若此时向容器中通入0.4molNO,一段时间后,重新达到新平衡时NO的体积分数_________33.3% (填“>”、“=”、“<”)。
(3)温度改变对反应II的催化剂活性有影响,评价催化剂活性参数:空时收率和CO选择性,表示式如下:
空时收率=![]()
CO的选择性=![]() ×100%
×100%
在不同温度下,某兴趣小组对四组其他条件都相同的反应物进行研究,经过相同时间t小时,测得空时收率、CO选择性数据如下表所示。
反应温度(℃) | 空时收率(g· mL-1· h-1) | CO的选择性(% ) |
130 | 0.70 | ① 72.5 |
140 | 0.75 | ② 71.0 |
150 | 0.71 | ③ 55.6 |
160 | 0.66 | ④ 63.3 |
下列说法正确的是_________。
A.温度升高,空时收率先增大后减少,说明△H2>0
B.温度升高,催化剂活性逐渐减弱,对CO的选择性逐渐降低,所以数据④肯定错误
C.130℃时,CO的选择性最高,说明CO生成CH3OOCCOOCH3的转化率最高
D.综合考虑空时收率和CO的选择性,工业生成CH3OOCCOOCH3时,选择140℃效果最好
(4)120℃、常压时,CH3OOCCOOCH3+4H2![]() HOCH2CH2OH +2CH3OH 反应过程中能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中能量变化图。_______
HOCH2CH2OH +2CH3OH 反应过程中能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中能量变化图。_______

(5)研究证实,乙二醇、氧气可以在碱性溶液中形成燃料电池,负极的电极反应式是_________。
【答案】 4CO (g)+ 8H2(g) +O2 (g)![]() 2HOCH2CH2OH(l) + 2H2O(g) △H=(a+2b+2c)kJ·mol-1 该反应能△S<0 ,自发进行的可能原因就是△H<0 > D
2HOCH2CH2OH(l) + 2H2O(g) △H=(a+2b+2c)kJ·mol-1 该反应能△S<0 ,自发进行的可能原因就是△H<0 > D  HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O
HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O
【解析】(1)反应 I:4NO(g)+ 4CH3OH (g)+ O2 (g)![]() 4CH3ONO(g)+ 2H2O(g) △H1=a kJ·mol-1,反应 II:2CO(g)+2CH3ONO(g)
4CH3ONO(g)+ 2H2O(g) △H1=a kJ·mol-1,反应 II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=bkJ·mol-1,反应III:CH3OOCCOOCH3 (1)+ 4H2(g)
CH3OOCCOOCH3(l)+2NO(g) △H2=bkJ·mol-1,反应III:CH3OOCCOOCH3 (1)+ 4H2(g)![]() HOCH2CH2OH(1)+ 2CH3OH (g) △H3=ckJ·mol-1,根据盖斯定律,将I+ II×2+III×2得4CO (g)+ 8H2(g) +O2 (g)
HOCH2CH2OH(1)+ 2CH3OH (g) △H3=ckJ·mol-1,根据盖斯定律,将I+ II×2+III×2得4CO (g)+ 8H2(g) +O2 (g)![]() 2HOCH2CH2OH(l) + 2H2O(g) △H=(a+2b+2c)kJ·mol-1,该反应能△S<0,在较低温条件下,自发进行的可能原因就是△H<0,故答案为:4CO (g)+ 8H2(g) +O2 (g)
2HOCH2CH2OH(l) + 2H2O(g) △H=(a+2b+2c)kJ·mol-1,该反应能△S<0,在较低温条件下,自发进行的可能原因就是△H<0,故答案为:4CO (g)+ 8H2(g) +O2 (g)![]() 2HOCH2CH2OH(l) + 2H2O(g) △H=(a+2b+2c)kJ·mol-1;该反应能△S<0 ,自发进行的可能原因就是△H<0;
2HOCH2CH2OH(l) + 2H2O(g) △H=(a+2b+2c)kJ·mol-1;该反应能△S<0 ,自发进行的可能原因就是△H<0;
(2)反应 II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g),CO、CH3ONO各0.4mol在恒温、容积恒定为2L的密闭容器中发生反应达到平衡时NO的体积分数33.3%,若此时向容器中通入0.4molNO,相当于增大NO浓度,平衡逆向移动,NO的体积分数增大,故答案为:>;
CH3OOCCOOCH3(l)+2NO(g),CO、CH3ONO各0.4mol在恒温、容积恒定为2L的密闭容器中发生反应达到平衡时NO的体积分数33.3%,若此时向容器中通入0.4molNO,相当于增大NO浓度,平衡逆向移动,NO的体积分数增大,故答案为:>;
(3)A.根据表格数据,温度升高,空时收率先增大后减少,空时收率与CH3OOCCOOCH3的质量、反应时间、催化剂的体积三个因素有关,温度越高,建立平衡需要的反应时间越少,不能判断CH3OOCCOOCH3的质量的变化,也就无法判断反应的焓变,故A错误;B.根据数据,温度升高,CO的选择性先逐渐降低,后又升高,说明反应温度在150℃时副反应较多,随着温度升高,催化剂活性可能逐渐增强,对CO的选择性又逐渐升高,故B错误;C.130℃时,CO的选择性最高,只能说明此时的副反应较少,不能说明CO生成CH3OOCCOOCH3的转化率是否最高,故C错误;D.在140℃时空时收率达到最高,CO的选择性也较高,副反应较少,因此工业生成CH3OOCCOOCH3时,选择140℃效果最好,故D正确;故选D。
(4)升高温度,反应速率加快,建立平衡的时间减少,加入催化剂,能够降低反应的活化能,反应速率加快,建立平衡的时间减少,但焓变不变;由于草酸二甲酯的沸点为164.5℃,因此升高温度至180℃,草酸二甲酯会发生气化,反应物的起始能量增大,但最终产物的能量不变,因此焓变增大,图像为 ,故答案为:
,故答案为: ;
;
(5)乙二醇、氧气在碱性溶液中形成燃料电池,乙二醇在负极发生氧化反应,负极的电极反应式为HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O,故答案为:HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O。


科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,以废铁屑为原料制备PFS的具体工艺流程如下:
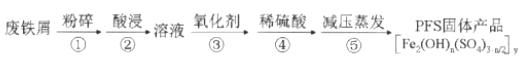
下列说法不正确的是( )
A. 步骤①,粉碎的目的是增大反应物接触面积,提高“酸浸”反应速率
B. 步骤③,可选用H2O2、Cl2、KMnO4等氧化剂将Fe2+转化为Fe3+
C. 步骤④,加稀硫酸调节pH在一定范围内,若pH偏小则Fe3+水解程度太弱,若pH偏大时则形成Fe(OH)3沉淀
D. 步骤⑤,减压蒸发,有利于降低蒸发温度防止产物分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究氯气的性质,某兴趣小姐设计如下实验:
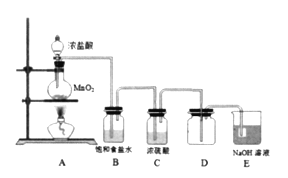
(1)装置B中饱和食盐水的作用是_________。
(2)点燃A处酒精灯,一段时间后,取出装置D,将烧红的铁丝伸入D中,可以观察到_________。
(3)有同学提出可用饱和Na2SO3溶液代替NaOH溶液吸收多余的氯气,其原因是________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L水含有的水分子数为NA
B. 常温常压下,22 g CO2含有的CO2分子数为0.5NA
C. 标准状况下,32 g O2和CO2的混合气体含有的氧原子数为2NA
D. 40 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
能使化学反应速率加快的措施有________(填序号)。
①增加C的物质的量 ②升高反应温度
③随时吸收CO、H2转化为CH3OH ④密闭定容容器中充入CO(g)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下两组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 2 | 4 | 0.8 | 3.2 | 3 |
①实验1中以v(CO2)表示的化学反应速率为________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
(3)在一容积为2 L的密闭容器内加入2 mol的CO和6 mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系如图所示:
CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系如图所示:

①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是________。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硅及其化合物的叙述中,不正确的是
A.硅是良好的半导体材料
B.二氧化硅能与石灰石反应:SiO2+CaCO3![]() CaSiO3+CO2↑
CaSiO3+CO2↑
C.可以用焦炭还原二氧化硅生产硅:SiO2 + 2C ![]() Si + 2CO↑
Si + 2CO↑
D.水泥的主要成分是 Na2SiO3、CaSiO3 和 SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从海水中提取溴的主要反应是:C12+2Br- = 2Cl- + Br2下列说法错误的是
A.海水中溴元素主要以形式Br-存在 B.上述反应属于离子反应
C.溴单质比氯单质活泼 D.上述反应属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物加氢反应后生成(CH3)2CHCH2OH,该有机物可能是
A.CH2=C(CH3)CH2OHB.CH3CH2CH2CHO
C.(CH3)2CHCOOHD.(CH3)3CCHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题。
(1)碳酸氢钠俗称小苏打,其水溶液显____________性(填“酸”、“碱”或“中”) ;
(2)等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者____________后者(填“>”、“<”或“=”) ;
(3)除去碳酸钠固体中碳酸氢钠的方法是____________(填“加热”或“溶解过滤”) ;
(4)若金属钠长时间在潮湿的空气中放置,最后生成的物质是_________;
(5)将一小块金属钠投入水中,发生反应的离子方程式为_________________________;
(6)铝是一种比较活泼的金属,在空气中极易被氧化而生成一种致密的氧化膜,从而保护内部的铝不再被氧化。请写出此反应的化学方程式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com