
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
(1)与氯元素同族的短周期元素的原子结构示意图为 .
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式: NaCl+ 3 H2O═ NaClO3+ .
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其他晶体析出的原因是 .
(4)一定条件下,在水溶液中1mol Cl﹣、ClOx﹣(x=1,2,3,4)的能量(kJ)相对大小如图所示.
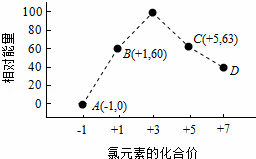
①D是 (填离子符号).
②B→A+C反应的热化学方程式为 (用离子符号表示).
| 真题集萃;氧化还原反应方程式的配平;反应热和焓变;热化学方程式;卤素原子结构及其性质的比较. | |
| 专题: | 氧化还原反应专题;化学反应中的能量变化;卤族元素. |
| 分析: | (1)与氯元素同族的短周期元素是F原子,F原子核外有2个电子层,最外层有7个电子,据此书写F的原子结构示意图; (2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强; (3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液NaClO3溶液KClO3晶体, ①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气; 两种化合物相互交换成分生成另外的两种化合物的反应为复分解反应,相同温度下,溶解度小的物质先析出; (4)一定条件下,在水溶液1 mol Cl﹣、ClOx﹣(x=1,2,3,4,)的能量(kJ)相对大小如图所示. ①D中Cl元素化合价为+7价,据此判断x值; ②B→A+C,根据转移电子守恒得该反应方程式为3ClO﹣=ClO3﹣+2Cl﹣,反应热=(63kJ/mol+2×0kJ/mol)﹣3×60kJ/mol=﹣117kJ/mol. |
| 解答: | 解:(1)与氯元素同族的短周期元素是F原子,F原子核外有2个电子层,最外层有7个电子,则F的原子结构示意图为 (2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强,与物质的沸点、氢化物水溶液的酸性无关,故选bc; (3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液 ①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气,所以反应方程式为1NaCl+3H2O═1NaClO3+3H2↑, 故答案为:1;3;1;3;H2↑; ②NaClO3转化为KClO3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3, 故答案为:复分解反应;室温下KClO3在水中的溶解度明显小于其它晶体; (4)①根据图象知,D中Cl元素化合价为+7价,所以ClOx﹣中x为4,则D为ClO4﹣,故答案为:ClO4﹣; ②B→A+C,根据转移电子守恒得该反应方程式为3ClO﹣=ClO3﹣+2Cl﹣,反应热=(63kJ/mol+2×0kJ/mol)﹣3×60kJ/mol=﹣117kJ/mol,所以该热化学反应方程式为3ClO﹣(aq)=ClO3﹣(aq)+2Cl﹣(aq)△H=﹣117kJ/mol,故答案为:3ClO﹣(aq)=ClO3﹣(aq)+2Cl﹣(aq)△H=﹣117kJ/mol. |
| 点评: | 本题以卤族元素为载体考查了氧化还原反应、热化学反应、非金属强弱的判断方法等知识点,根据物质的性质、原子结构结合元素周期律等知识点来分析解答,题目难度中等. |


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
2014年10月24日双鸭山市区发生严重的雾霾天气,对人们的健康造成严重威胁,环境问题离我们也并不遥远了,则下列有关环境问题说法正确的是( )
A. PH<7的雨水称为酸雨
B. 二氧化硫的大量排放是造成光化学烟雾的主要原因
C. PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生相关
D. SO2、CO2、NO2均属于大气污染物
查看答案和解析>>
科目:高中化学 来源: 题型:
通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银):n(硝酸亚汞)=2:1,则下列叙述正确的是( )
|
| A. | 电解后溶液的pH都增大 |
|
| B. | 在两个阳极上得到的产物的物质的量不相等 |
|
| C. | 硝酸亚汞的分子式为Hg2(NO3)2 |
|
| D. | 在两个阴极上得到的银和汞的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
往含Fe3+、H+、NO3﹣的混合液中加入少量含SO32﹣的某溶液充分反应后(设溶液中的其他成分不反应),下列表示该混合溶液中发生反应的离子方程式中正确的是( )
|
| A. | 2 Fe3++SO32﹣+H2O→2 Fe2++SO42﹣+2 H+ |
|
| B. | 2 H++SO32﹣→SO2↑+H2O |
|
| C. | 2 H++2 NO3﹣+3 SO32﹣→3 SO42﹣+2 NO+H2O |
|
| D. | 2 Fe3++3 SO32﹣+3 H2O→2 Fe(OH)3↓+3 SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
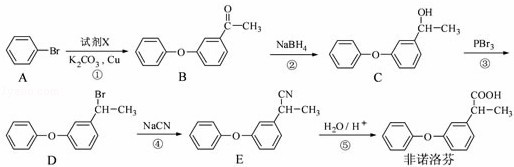
请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称).
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为 .
(3)在上述五步反应中,属于取代反应的是 (填序号).
(4)B的一种同分异构体满足下列条件:
Ⅰ、能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应.
Ⅱ、分子中有6种不同化学环境的氢,且分子中含有两个苯环.
写出该同分异构体的结构简式: .
(5)根据已有知识并结合相关信息,写出以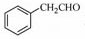 为原料制备
为原料制备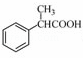 的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
CH3CH2Br CH3CH2OH
CH3CH2OH CH3COOCH2CH3.
CH3COOCH2CH3.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质属于同分异构体的是( )
②乙醚和乙醇③乙酸和甲酸甲酯④淀粉和纤维素
⑤苯甲醇和甲基苯酚
⑥葡萄糖和果糖⑦丙烯酸和油酸⑧丙醛和丙烯醇
A.①②④⑦ B.②④⑥⑧ C.③⑤⑥⑧ D.①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
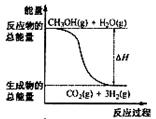
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是 ( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X2、Y2、Z2、W2四种物质的氧化能力强弱顺序为:W2>Z2>X2>Y2,判断下列氧化还原反应,能够发生的是( )
A.2W-+Z2===2Z-+W2 B.2X-+Y2===2Y-+X2
C.2Y-+W2===2W-+Y2 D.2Z-+X2===2X-+Z2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com