
| A. | 氯水 | B. | Na2S溶液 | C. | SO2 | D. | 稀H2SO4 | ||||
| E. | Fe3+ |
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | H++OH-=H2O表示所有强酸和强碱的反应 | |
| B. | 溶于水后能够电离出H+的化合物都是酸 | |
| C. | 单质和氧化物在离子方程式中不能用离子符号表示 | |
| D. | 凡是易溶于水的化合物都可以写成离子形式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1NaCl溶液 | B. | 100 mL 3 mol•L-1KClO3溶液 | ||
| C. | 75 mL 2 mol•L-1MgCl2溶液 | D. | 50 mL 1 mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 混合物 | 试剂序号 | 方法序号 |
| (1) | 硝酸钾和氯化钠的固体混合物 | ||
| (2) | 氯化钾和溴的混合液 | ||
| (3) | 汽油和水的混合物 | ||
| (4) | 乙二醇(沸点198℃)和丙三醇(沸点290℃)的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 钠 | Na2O | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 97.8 | 1132 | 851 | 3550 | 3850 |
| 沸点(℃) | 882.9 | 1275 | 1850(分解产生CO2) | 4250 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Mg2+ | C. | Cu2+ | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
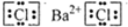 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
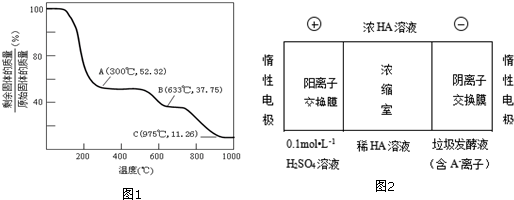
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com