
【题目】氨的合成对国家工业发展有着举足轻重的作用,请根据化学原理知识回答下列问题:
(1)已知氢气的燃烧热为285.8kJ/mol。
4NH3 (g) +5O2 (g) ![]() 4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
N2(g)+ O2(g)═ 2NO(g)△H = +180.6kJ/mol。
则工业合成氨的热化学方程式为________________。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。实验结果如图所示:(图中 T表示温度, n表示物质的量)

①图像中 T2和 T1的关系是: T2 _______________ T1(填“高于”、“低于”、 “等于”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N 2 的转化率最高的是_______________(填字母)。
③在起始体系中n(N2):n(H2)= 1:3时,反应后氨的百分含量最大;若容器容积为1L, n=3mol反应达到平衡时H2的转化率为60%,则此条件下( T 2),反应的平衡常数 K=__________________。
(3)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2![]() N2O4 H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小)。下列说法正确的是______________
N2O4 H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小)。下列说法正确的是______________

A.b点的操作是压缩注射器
B.c点与a点相比, c(NO2)增大, c(N2O4)减小
C.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)> v(逆)
(4)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。

①电极a为___________________极,其电极反应式为__________________。
②当有0.1 mol NO2被处理时,转移电子为________________mol。
③为使电池持续放电,该离子交换膜需选用___________________交换膜。
【答案】 N2(g)+3H2(g)![]() 2NH3(g) △H = -92.4kJ/mol 低于 C 25/12 或2.08或2.1 AC 负 2NH3—6e—+6OH—=N2+6H2O 0.4 阴离子
2NH3(g) △H = -92.4kJ/mol 低于 C 25/12 或2.08或2.1 AC 负 2NH3—6e—+6OH—=N2+6H2O 0.4 阴离子
【解析】(1)①H2(g)+![]() O2(g)=H2O(l)△H1=-285.8 kJmol-1;②4NH3 (g) +5O2 (g)
O2(g)=H2O(l)△H1=-285.8 kJmol-1;②4NH3 (g) +5O2 (g) ![]() 4NO(g) + 6H2O(l) △H2= —1168.8kJ/mol ;③N2(g)+ O2(g)═ 2NO(g)△H3 = +180.6kJ/mol;根据盖斯定律可知,③+①×3-②×
4NO(g) + 6H2O(l) △H2= —1168.8kJ/mol ;③N2(g)+ O2(g)═ 2NO(g)△H3 = +180.6kJ/mol;根据盖斯定律可知,③+①×3-②×![]() 可得:N2(g)+3H2(g)2NH3(g),则△H=(+180.6kJ/mol)+(-285.8 kJmol-1)×3-(—1168.8kJ/mol)×
可得:N2(g)+3H2(g)2NH3(g),则△H=(+180.6kJ/mol)+(-285.8 kJmol-1)×3-(—1168.8kJ/mol)×![]() =-92.4 kJmol-1;
=-92.4 kJmol-1;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,故答案为c;
③当氮气和氢气的物质的量之比为1∶3时达平衡状态时氨的百分含量最大,平衡点时产物的产率最大,当n=3mol反应达到平衡时H2的转化率为60%,故起始氮气浓度为1.2mol/l,变化的氢气浓度为1.8mol/l,变化的氮气浓度为0.6mol/l,平衡时氮气、氢气、氨气的浓度分别是0.4mol/l、1.2mol/l、1.2mol/l,据K=![]() =
=![]() =2.08;
=2.08;
(3)A.b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A正确;B.c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故B错误;C.b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),升温平衡逆向移动,平衡常数减小,所以Kb>Kc,故C正确;D.c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故D错误;故答案为AC。
(4)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则a为负极,b为正极,负极电极方程式为2NH3-6e-+60H-=N2+6H2O;
②当有0.1molNO2 被处理时,转移电子为0.1mol×(4-0)=0.4mol;
③原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作。


科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列有关说法正确的是
A. 点燃爆竹后,硫燃烧生成SO3
B. 中国古代利用明矾溶液的酸性清除铜镜表明的铜锈
C. 服用阿司匹林出现水杨酸反应时,用NaOH溶液解毒
D. 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应时,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的盐酸和氢氧化钠的物质的量之比为( )
A. 1∶1 B. 2∶1 C. 3∶1 D. 1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数, B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。

(1)基态E原子的价电子排布图_______________。
(2)B、C、D三元素第一电离能由大到小的顺序为(用元素符号表示)______________。
(3)BD32-中心原子杂化轨道的类型为________杂化;CA4+的空间构型为__________(用文字描述)。
(4)1mol BC-中含有π键的数目为______NA。
(5)D、E元素最简单氢化物的稳定性 > (填化学式),理由是 。
(6)C、F两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是 ,C原子的配位数是 。若相邻C原子和F原子间的距离为anm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年法国、美国和荷兰的三位化学家因“分子马达”方面的研究,获得诺贝尔化学奖。下面是其中一种光驱分子马达的结构,关于其结构的说法正确的是

A. 该分子的化学式为C22H44O2
B. 分子中最多有6个原子在一条直线上
C. lmol该分子最多可与8molH2发生反应
D. 该分子可以发生氧化、加成、酯化和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,器合成路线如下:
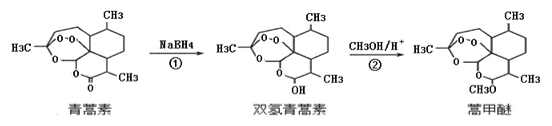
下列说法不正确的是()
A. 青蒿素的分子式是C15H22O5,属于烃的衍生物
B. 双氢青蒿素中含有过氧键,遇湿润的淀粉碘化钾试纸立刻显蓝色
C. 蒿甲醚可以犮生水解反应
D. 反应②为取代反应,有H2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,都是由极性键构成极性分子的一组是( )
A. NO2和CH4 B. NH3和H2O C. H2S和CCl4 D. HCl和C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键、离子键、范德华力、氢键和金属键是构成物质粒子间的不同作用方式。下列物质中,只含有上述一种作用的是( )
A. 冰 B. 氢氧化钠 C. 铁 D. 石墨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com