
白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P===O c kJ·mol-1、O===O d kJ·mol-1。
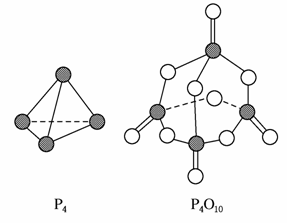
根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b)kJ·mol-1
B.(4c+12d-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1
D.(4a+5d-4c-12b)kJ·mol-1
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.镍氢电池、锂电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铅蓄电池放电的时候正极材料是Pb,负极材料是PbO2
查看答案和解析>>
科目:高中化学 来源: 题型:
1830年,法国化学品制造商库尔曼就提出,氨能跟氧气在铂催化下得到硝酸,其中第一步反应为:4NH3+5O2===4NO+6H2O(各物质均为气态),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol·L-1·min-1]表示,则正确的关系是( )
A.4v(NH3)/5=v(O2) B.5v(O2)/6=v(H2O)
C.2v(NH3)/3=v(H2O) D.4v(O2)/5=v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在一定条件下,2SO2(g)+O2(g)2SO3(g)
ΔH=-197 kJ/mol,在此条件下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量Q1,则下列关系式正确的是( )
A.Q1=197 kJ B.Q1<197 kJ
C.Q1<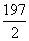 kJ D.Q1>197 kJ
kJ D.Q1>197 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 mol氢气完全燃烧生成水蒸气时放出能量242 kJ,拆开1 mol氧气中的化学键需要吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ。计算氢气中1 mol H—H键断裂时吸收多少能量?
查看答案和解析>>
科目:高中化学 来源: 题型:
铜板上铁铆钉处的电化学腐蚀原理如图所示,下列有关说法不正确的是( )
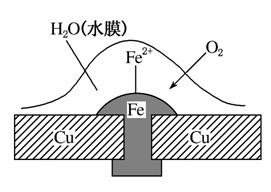
A.正极的电极反应式为:2H++2e-===H2↑
B.此过程中还涉及反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
实验是研究化学的基础,试回答以下问题:
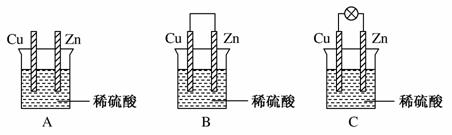
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察锌片上有气泡,再平行插入一块铜片(见图A),可观察到铜片________(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图B),组成一个原电池,负极为________,正极的电极反应式为________;
(2)如果烧杯中最初装入的是500 mL 2 mol·L-1的稀硫酸溶液,构成铜锌原电池(见图C,假设产生的气体没有损失),当在标准状况下收集到11.2 L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=________mol·L-1,c(ZnSO4)=________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有乙酸和两种链状单烯烃(分子中含一个碳碳双键)的混合物,若其中氧的质量分数为a,则碳的质量分数是( )
A.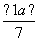 B.
B.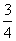 a
a
C.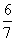 (1-a) D.
(1-a) D.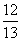 (1-a)
(1-a)
查看答案和解析>>
科目:高中化学 来源: 题型:
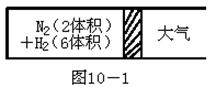 在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图10-1)。
在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图10-1)。
容器中发生如下反应:N2+3H2  2NH3;△H<0。反应达到平衡后,测得混合气体为7体积。
2NH3;△H<0。反应达到平衡后,测得混合气体为7体积。
 ⑴保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。那么:①a=1,c=2,则b== 。在此情况下,反应起始时将向 方向(填“正”或“逆”)进行。
⑴保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。那么:①a=1,c=2,则b== 。在此情况下,反应起始时将向 方向(填“正”或“逆”)进行。
②若需规定起始时反应向逆方向进行,则c的取值范围是 。
⑵在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是 ,原因是________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com