
分析 (1)反应方程式为:N2H4+2H2O2=N2+4H2O,根据0.4mol液态肼放出的热量,计算1mol液态肼放出的热量,进而写出热化学方程式;
(2)结合上述写出的热化学方程式和水转化的热化学方程式,根据盖斯定律合并写出生成气态水时的热化学方程式进行计算;
(3)依据反应N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)的产物是氮气和水分析该反应的优点;
(4)依据热化学方程式,结合目标热化学方程式,利用盖斯定律计算得到.
解答 解:(1)反应方程式为:N2H4+2H2O2═N2+4H2O,0.4mol液态肼放出327.04kJ的热量,则1mol液态肼放出的热量为$\frac{327.04kJ}{0.4mol}$=817.6kJ,
所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.6kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(l)△H=-817.6kJ/mol;
(2)①N2H4(g)+2H2O2(l)=N2(g)+4H2O(l)△H=-817.6kJ/mol;
②H2O(g)=H2O(l)△H=-44kJ/mol;
依据盖斯定律①-②×4得到:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.6kJ/mol;
热化学方程式中32g全部反应放热641.6kJ,16g液态肼与足量双氧水反应生成氮气和气态水时,放出的热量为:641.6kJ×$\frac{1}{2}$=320.8kJ,
故答案为:320.8;
(3)还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,除释放大量热量和快速产生大量气体外,还有很突出的优点是,产物为氮气和水,清洁无污染,故答案为:产物无污染;
(4)①N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
②$\frac{1}{2}$H2(g)+$\frac{1}{2}$F2(g)=HF(g)△H=-269kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ•mol-1
依据盖斯定律①-③×2+②×4得到:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ•mol-1;
故答案为:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ•mol-1.
点评 本题考查了热化学方程式的书写、有关反应热的计算,题目难度中等,注意盖斯定律的应用,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
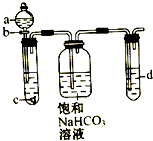 某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.
某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.| 实 验 | 实验现象 | 结 论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞溶液 | 溶液变成红色 | 固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液 | 产生白色沉淀 | 固体产物是Na2CO3,而不是NaOH |
| 实验三:取少量反应后的固体产物溶于水,加入足量稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
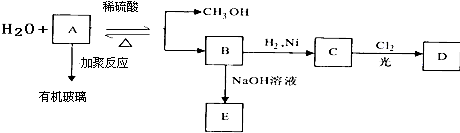
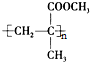 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同温同压下,相同体积的气体,其分子数一定相等,原子数也一定相等 | |
| B. | 任何条件下,等物质的量的甲烷(CH4)和一氧化碳,体积一定相同 | |
| C. | 同温同压下的一氧化碳气体和氮气,若体积相等,则质量一定相等 | |
| D. | 1 mol由Na2O2和Na2O组成的混合物,其中的钠离子为2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com