
ĻĀĮŠŹµŃé²»ÄÜ“ļµ½ŹµŃéÄæµÄµÄŹĒ( )
¢ŁŹµŃéÖĻÓĆĪŽĖ®ŅŅ“¼ŗĶÅØĮņĖį¹²Čȵ½140”ę¼“æÉÖĘČ”ŅŅĻ©
¢ŚŃéÖ¤R”ŖXŹĒµā“śĶ飬°ŃR”ŖXÓėNaOHĖ®ČÜŅŗ»ģŗĻ¼ÓČČ£¬ŌŁĶłĘäÖŠ¼ÓČėĻõĖįŅųČÜŅŗ¼“æÉ
¢Ū×öČ©µÄ»¹ŌŠŌŹµŃ飬ĻņŅŅČ©ČÜŅŗÖŠ¼ÓČėŠĀÖʵÄCu(OH)2Šü×ĒŅŗ¼“æɵƵ½ŗģÉ«³Įµķ
¢Ü¼ģŃéµķ·ŪŅŃĖ®½ā£¬½«µķ·ŪÓėĖ®ŗĶĻ”ĮņĖį¼ÓČČŅ»¶ĪŹ±¼äŗ󣬼ÓČėŅų°±ČÜŅŗ¼“æÉ
¢ŻŹµŃéŹŅÖʱøŅŅĖįŅŅõ„£¬°ŃŅŅ“¼ŗĶŅŅĖį¼°Ļ”ĮņĖįČÜŅŗ¹²ČČ¼“æÉ
A£®¢Ł¢Ś¢Ū¢Ü¢Ż B£®¢Ł¢Ū¢Ü C£®¢Ł¢Ś¢Ū¢Ż D£®¢Ś¢Ū¢Ż
 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
0.4 mol CuCl2ČÜÓŚĖ®£¬Åä³É1 LČÜŅŗ£¬ÓĆŹÆÄ«µē¼«½ųŠŠµē½ā£¬µ±Ņ»øöµē¼«µĆµ½0.3 mol CuŹ±£¬ĮķŅ»øöµē¼«ÉĻÉś³ÉµÄĘųĢåŌŚ±ź×¼×“æöĻĀµÄĢå»żŹĒ(””””)
A£®5.6 L B£®6.72 L
C£®3.36 L D£®11.2 L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠÓŠ¹ŲŌ×Ó½į¹¹ŗĶŌŖĖŲÖÜĘŚĀɵıķŹöÕżČ·µÄŹĒ(””””)
¢ŁŌ×ÓŠņŹżĪŖ15µÄŌŖĖŲµÄ×īøß»ÆŗĻ¼ŪĪŖ£«3””¢Ś¢÷A×åŌŖĖŲŹĒĶ¬ÖÜĘŚÖŠ·Ē½šŹōŠŌ×īĒæµÄŌŖĖŲ””¢ŪµŚ¶žÖÜĘŚ¢ōA×åŌŖĖŲµÄŌ×ÓŗĖµēŗÉŹżŗĶÖŠ×ÓŹżŅ»¶ØĪŖ6””¢ÜŌ×ÓŠņŹżĪŖ12µÄŌŖĖŲĪ»ÓŚŌŖĖŲÖÜĘŚ±ķµÄµŚČżÖÜĘŚ¢ņA×å
A£®¢Ł¢Ś B£®¢Ł¢Ū
C£®¢Ś¢Ü D£®¢Ū¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A£®ČéĖį±”ŗÉ“¼õ„£Ø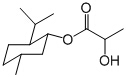 £©½öÄÜ·¢ÉśĖ®½ā”¢Ńõ»Æ”¢ĻūČ„·“Ó¦
£©½öÄÜ·¢ÉśĖ®½ā”¢Ńõ»Æ”¢ĻūČ„·“Ó¦
B£®ŅŅČ©ŗĶ±ūĻ©Č©£Ø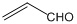 £©²»ŹĒĶ¬ĻµĪļ£¬ĖüĆĒÓėĒāĘų³ä·Ö·“Ó¦ŗóµÄ²śĪļŅ²²»ŹĒĶ¬ĻµĪļ
£©²»ŹĒĶ¬ĻµĪļ£¬ĖüĆĒÓėĒāĘų³ä·Ö·“Ó¦ŗóµÄ²śĪļŅ²²»ŹĒĶ¬ĻµĪļ
C£®µķ·ŪŗĶĻĖĪ¬ĖŲŌŚĖį“ß»ÆĻĀĶźČ«Ė®½āŗóµÄ²śĪļ¶¼ŹĒĘĻĢŃĢĒ
D£®CH3COOCH2CH3ÓėCH3CH2COOCH3»„ĪŖĶ¬·ÖŅģ¹¹Ģ壬1H-NMRĘ×ĻŌŹ¾Į½Õß¾ł ÓŠČżÖÖ²»Ķ¬µÄĒāŌ×ÓĒŅČżÖÖĒāŌ×ӵıȥżĻąĶ¬£¬¹Ź²»ÄÜÓĆ1H-NMRĄ“¼ų±š
ÓŠČżÖÖ²»Ķ¬µÄĒāŌ×ÓĒŅČżÖÖĒāŌ×ӵıȥżĻąĶ¬£¬¹Ź²»ÄÜÓĆ1H-NMRĄ“¼ų±š
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚ10L ŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėX£Øg£©ŗĶY(g)£¬·¢Éś·“Ó¦X£Øg£©+Y£Øg£© M£Øg£©+N£Øg£©£¬ĖłµĆŹµŃ鏿¾ŻČēĻĀ±ķ£ŗ
M£Øg£©+N£Øg£©£¬ĖłµĆŹµŃ鏿¾ŻČēĻĀ±ķ£ŗ
| ŹµŃé | ĪĀ¶Č/”ę | ĘšŹ¼Ź±ĪļÖŹµÄĮæ/mol | Ę½ŗāŹ±ĪļÖŹµÄĮæ/mol | |
| n(X) | n(Y) | n(M) | ||
| ¢Ł | 700 | 0.40 | 0.10 | 0.090 |
| ¢Ś | 800 | 0.10 | 0.40 | 0.080 |
| ¢Ū | 800 | 0.20 | 0.30 | a |
| ¢Ü | 900 | 0.10 | 0.15 | b |
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A£®ŹµŃé¢ŁÖŠ£¬Čō5minŹ±²āµĆn(M)=0.050mol£¬Ōņ0ÖĮ5minŹ±¼äÄŚ£¬ÓĆN±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹv£ØN£©=1.0”Į10-2mol/(L”¤min)
B£®ŹµŃé¢ŚÖŠ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK=2.0
C£®ŹµŃé¢ŪÖŠ£¬“ļµ½Ę½ŗāŹ±£¬XµÄ×Ŗ»ÆĀŹĪŖ60%
D£®ŹµŃé¢ÜÖŠ£¬“ļµ½Ę½ŗāŹ±£¬b>0.060
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
³£ĪĀĻĀ£¬ĻĀĮŠø÷×éĄė×ÓŌŚÖø¶ØČÜŅŗÖŠÄÜ“óĮæ¹²“ęµÄŹĒ
A£®pH=1µÄČÜŅŗÖŠ£ŗFe2+”¢NO3£”¢SO42£”¢Na+
B£®c(H+)/c(OH£)=1012µÄČÜŅŗÖŠ£ŗNH4+”¢Al3+”¢NO3£”¢Cl£
C£®ÓÉĖ®µēĄėµÄc(H+)=1”Į10£14mol”¤L£1µÄČÜŅŗÖŠ£ŗCa2+”¢K+”¢Cl£”¢HCO3£
D£®c(Fe3+)=0.1mol”¤L£1µÄČÜŅŗÖŠ£ŗK+”¢ClO£”¢SO42£”¢SCN£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ģ¼¼°Ęä»ÆŗĻĪļÓ¦ÓĆ¹ć·ŗ”£
I£®¹¤ŅµÉĻĄūÓĆCOŗĶĖ®ŌŚ·ŠŹÆ·Ö×ÓÉø±ķĆę·“Ó¦ÖĘĒāĘų£¬CO(g)£«H2O(g) CO2(g)£«H2(g)
CO2(g)£«H2(g)
£Ø1£©Ļņ 1LŗćČŻĆܱÕČŻĘ÷֊עČėCOŗĶH2O£Øg£©£¬830oCŹ±£¬²āµĆ²æ·ÖŹż¾ŻČēĻĀ±ķ”£
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO)/mol | 0.200 | 0.160 | 0.125 | 0.099 | 0.080 | 0.080 |
| n(H2O)/mol | 0.300 | 0.260 | 0.225 | 0.199 | 0.180 | 0.180 |
ŌņøĆĪĀ¶ČĻĀ·“Ó¦µÄĘ½ŗā³£ŹżK=””””””””””””””””””””
£Ø2£©ĻąĶ¬Ģõ¼žĻĀ£¬Ļņ 1LŗćČŻĆܱÕČŻĘ÷ÖŠ£¬Ķ¬Ź±×¢Čė1molCO”¢1molH2O(g)”¢2molCO2ŗĶ2molH2£¬“ĖŹ±v£ØÕż£©”””””” ””v£ØÄę£©£ØĢī”°£¾”±”°£½”±»ņ”°£¼”±£©
II£®ŅŃÖŖ£ŗCO(g)+1/2O2(g)=CO2(g)”””””””” ”” ”÷H1=£141kJ”¤mol£1
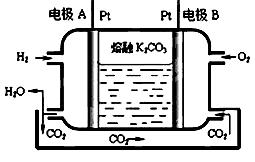 ””””””””””2H2(g)+O2(g)=2H2O(g)”””””””” ”÷H2=£484kJ”¤mol£1
””””””””””2H2(g)+O2(g)=2H2O(g)”””””””” ”÷H2=£484kJ”¤mol£1
””””””””””CH3OH£Øl£©+3/2O2(g)=CO2(g)+2H2O(g)”” ”””÷H3=£726kJ”¤mol£1
£Ø3£©ĄūÓĆCO”¢H2»ÆŗĻÖʵĆŅŗĢ¬¼×“¼µÄČČ»Æѧ·½³ĢŹ½
ĪŖ””””””””””””””””””””””””””””””””
¢ó£®Ņ»ÖÖŠĀŠĶĒāŃõČ¼ĮĻµē³Ų¹¤×÷ŌĄķČēĻĀĶ¼ĖłŹ¾”£
£Ø4£©Š“³öµē¼«AµÄµē¼«·“Ó¦Ź½””””””””””””””””””””””””””””””””””””””””””””””
·Åµē¹ż³ĢÖŠ£¬ČÜŅŗÖŠµÄCO32-½«ŅĘĻņµē¼« £ØĢīA»ņB£©
£Ø5£©ŅŌÉĻŹöµē³Ųµē½ā±„ŗĶŹ³ŃĪĖ®£¬ČōÉś³É0.2mol Cl2£¬ŌņÖĮÉŁŠčĶØČėO2µÄĢå»żĪŖ”””””””””” L£Ø±ź×¼×“æö£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĮŠĖµ·ØÕżČ·µÄŹĒ (””””)
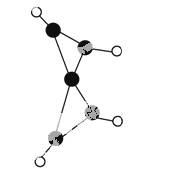
A.X¼ČÄÜŹ¹äåµÄĖÄĀČ»ÆĢ¼ČÜŅŗĶŹÉ«£¬ÓÖÄÜŹ¹ĖįŠŌKMnO4ČÜŅŗĶŹÉ«
B.XŹĒŅ»ÖÖ³£ĪĀĻĀÄÜĪČ¶Ø“ęŌŚµÄŅŗĢ¬Ģž
C.XŗĶŅŅĶ饹ĖĘ£¬¶¼ČŻŅ×·¢ÉśČ”“ś·“Ó¦
D.³ä·ÖČ¼ÉÕµČÖŹĮæµÄXŗĶ¼×Ķ飬XĻūŗÄŃõĘų½Ļ¶ą
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com