
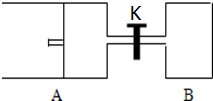
 ��ͼ��ʾ����A�г���1mol X��1mol Y����B�г���2mol X��2mol Y����ʼʱ��V��A��=V��B��=a L������ͬ�¶Ⱥ��д������ڵ������£��������и��Է���������Ӧ��X��g��+Y��g��?2Z��g��+W��g����H��0�ﵽƽ��ʱ��V��A��=1.2aL���Իش�
��ͼ��ʾ����A�г���1mol X��1mol Y����B�г���2mol X��2mol Y����ʼʱ��V��A��=V��B��=a L������ͬ�¶Ⱥ��д������ڵ������£��������и��Է���������Ӧ��X��g��+Y��g��?2Z��g��+W��g����H��0�ﵽƽ��ʱ��V��A��=1.2aL���Իش����� ��1��AΪ���º�ѹ���̣����֮�ȵ������ʵ���֮�ȣ��ݴ˼���ƽ���A��ƽ��ʱ�����������ʵ��������ݲ���������μӷ�Ӧ��X�����ʵ���������ת���ʶ�����㣻
��2��AΪ���º�ѹ������BΪ���º�����������Ӧǰ���������������ķ�Ӧ��A�г���1mol X��1mol Y����B�г���2mol X��2mol Y��B�����൱����ѹǿ��ƽ��������У�ƽ���A�е�X��ת���ʴ�
��3����ΪB�����ij�ʼ����A������2��������ͬ�¶��£���A�����������B��������Ķ���֮һ����0.5aL��ʱ���ﵽƽ�����ֵ�Ũ�ȡ��ٷֺ�����������ѹǿ����ȣ���ѹǿΪPB�����Ѵ�ʱA���������0.5a�������Ϊ1.4aL��������ƽ���ƶ�ʱѹǿ���Ϊ $\frac{5{P}_{B}}{14}$�����ٽ���ƽ��ʱ��A������ԭƽ�⽫������Ӧ�����ƶ�����������������ʵ���Ҫ���ӣ�������仯��ѹǿ��Ӱ���
��4����Ӧǰ����������ʵ������䣬�ʴ�K�����¶Ȳ��䣬�ִﵽƽ���뿪ʼA�г���1mol X��1mol Y�����ƽ����ͬ������X��ת���ʼ���ת����X�����ʵ�������������ƽ����ܵ����ʵ���������������ƽ����������ܵ����ʵ������ٸ������֮�ȵ������ʵ���֮�ȼ������������������A������������ݴ��жϣ�
��5���ڣ�3����ƽ���ͬʱ�ȷ�����A��B���¶ȣ�X+Y?2Z+W��H��0����Ӧ�Ƿ��ȷ�Ӧ������ƽ��������У�
��� �⣺��1��AΪ���º�ѹ���̣��ﵽƽ��ʱVA=1.2a L����ѹ���������£���������֮�ȵ�����������ʵ���֮�ȣ�����ƽ�������������ʵ�����2mol��1.2=2.4mol����μӷ�Ӧ��X�����ʵ���Ϊm mol����
X��g��+Y��g��?2Z��g��+W��g�� ���ʵ�������
1mol 1mol
mmol ��2.4-2��mol
���ԣ�m=0.4
����X���ʵ�ת����=$\frac{0.4mol}{1mol}$��100%=40%��
�ʴ�Ϊ��40%��
��2��AΪ���º�ѹ������BΪ���º�����������Ӧǰ���������������ķ�Ӧ��A�г���1mol X��1mol Y����B�г���2mol X��2mol Y��B��ѹǿ����ƽ��������У�X��ת���ʼ�С��ƽ���A�е�X��ת���ʴ���B��X��ת���ʣ�
�ʴ�Ϊ������
��3����ΪB�����ij�ʼ����A������2��������ͬ�¶��£���A�����������B��������Ķ���֮һ����0.5aL��ʱ���ﵽƽ�����ֵ�Ũ�ȡ��ٷֺ�����������ѹǿ����ȣ���ѹǿΪPB�����Ѵ�ʱA���������0.5a�������Ϊ1.4aL��������ƽ���ƶ�ʱѹǿ���Ϊ5PB/14�����ٽ���ƽ��ʱ��A������ԭƽ�⽫������Ӧ�����ƶ�����������������ʵ���Ҫ���ӣ�������仯��ѹǿ��Ӱ���PB��2PA��
�ʴ�Ϊ������
��4����K����ƽ���ЧΪA�е����ƽ�⣬X��ת����Ϊ40%���μӷ�Ӧ��X���ܵ����ʵ���Ϊ3mol��40%=1.2mol����
X��g��+Y��g��?2Z��g��+W��g�� ���ʵ�������
1mol 1mol
1.2mol 1.2mol
��ƽ����������ܵ����ʵ���Ϊ��1mol+1mol+2mol+2mol��+1.2mol=7.2mol����������֮�ȵ�����������ʵ���֮�ȣ��������������ΪaL��$\frac{7.2mol}{2mol}$=3.6a����A�����Ϊ3.6a-a=2.6a��
�ʴ�Ϊ��2.6a��
��5���ڣ�3����ƽ���ͬʱ�ȷ�����A��B���¶ȣ�����ƽ���A�������X+Y?2Z+W��H��0����Ӧ�Ƿ��ȷ�Ӧ������ƽ��������У�A���������С��
�ʴ�Ϊ����С��
���� ���⿼�黯ѧƽ��Ľ����ͱ仯��������������ı仯�����֮�ȵ������ʵ���֮�ȣ�ע��AB����������Ӧ�ã���Ŀ�ѶȽϴ�


 ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д� �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д� С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ҫ����480mL����Һ��Ӧѡ��500mL����ƿ | |
| B�� | ����NaOH��ŵ��ձ��г��� | |
| C�� | �ѳƺõĹ����ˮ�ܽ������ת�Ƶ�����ƿ�� | |
| D�� | ����ʱ���ӿ̶��ߣ�����NaOH��ҺŨ�Ȼ�ƫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
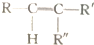 $\stackrel{�������������Һ}{��}$R-COOH+
$\stackrel{�������������Һ}{��}$R-COOH+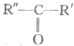
 ��HOOC��CH2��4COOH��
��HOOC��CH2��4COOH���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3F | B�� | CCl4 | C�� | COCl2 | D�� | CH2ClCOOH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
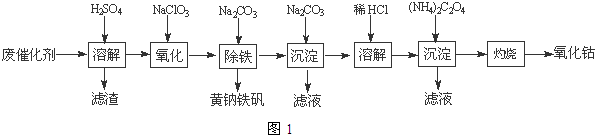
 ��4�����������ɳ�����ʽ̼����[��CoCO3��2•3Co��OH��2]��������ϴ�ӣ�ϴ�ӵIJ�������©���м�������ˮ����û����������ʹ��Һ�������ظ�����2��3�Σ�
��4�����������ɳ�����ʽ̼����[��CoCO3��2•3Co��OH��2]��������ϴ�ӣ�ϴ�ӵIJ�������©���м�������ˮ����û����������ʹ��Һ�������ظ�����2��3�Σ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
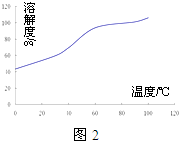
 ʵ������ͭ��ȡ����ͭ������������ֶ�μ��뵽ͭ����ϡ����Ļ�����м��ȣ�ʹ֮��Ӧ��ȫ��ͨ���������ᾧ�õ�����ͭ���壮
ʵ������ͭ��ȡ����ͭ������������ֶ�μ��뵽ͭ����ϡ����Ļ�����м��ȣ�ʹ֮��Ӧ��ȫ��ͨ���������ᾧ�õ�����ͭ���壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϩ�Ľṹ��ʽΪ��C2H4 | |
| B�� | S2-�Ľṹʾ��ͼ�� | |
| C�� | ������Ϊ53��������Ϊ78�ĵ�ԭ�ӣ�${\;}_{53}^{131}$I | |
| D�� | NH4Cl�ĵ���ʽΪ��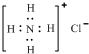 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com