
����Ŀ��50ml0.50molL��1������50mL0.55molL��1NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���� �зų��������ɼ����к��ȣ��ش��������⣺ 
��1����ʵ��װ���Ͽ���ͼ��ȱ�ٵ������� ��
��2��ʵ��������70mL0.50molL��1�����70mL0.55molL��1NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������������ȡ�����ȡ����������к��������ȡ�����ȡ�����
��3����50ml0.25molL��1H2SO4�������ᣬ��50mL0.275molL��1Ba��OH��2���� NaOH��Һ��������ʵ�飬��õ��к��ȵľ���ֵ�����ƫ��ƫС������Ӱ�족����
���𰸡�
��1������������
��2������ȣ����
��3��ƫ��
���������⣺��1���������ȼƵĹ����֪��װ�õ�ȱ�������ǻ��β�������������Դ��ǣ����β������������2����Ӧ�ų����������������Լ�������Ķ����йأ�������70mL0.50molL��1�����70mL0.55molL��1NaOH��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������࣬���ų�������ƫ�ߣ������к��ȵľ���ǿ���ǿ�Ӧ����1molˮʱ�ų����ȣ������������أ�������70mL0.50molL��1�����70mL0.55molL��1NaOH��Һ���з�Ӧ����������ʵ�飬����к�����ֵ��ȣ����Դ��ǣ�����ȣ���ȣ���3��������Ba��OH��2��Һ��Ӧ��������ˮ�⣬��������BaSO4�������÷�Ӧ�е������Ȼ�Ӱ�췴Ӧ�ķ�Ӧ�ȣ����Բ�����Ba��OH��2��Һ���������NaOH��Һ��������к��ȣ�������к��ȵ���ֵƫ�����Դ��ǣ�ƫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʮ�����Ǿ��иߴ����ܶȵ��������壬������ʮ������C10H18������������C10H12��������C10H8��������������ͷ���������֪��
C10H18(l)![]() C10H12(l)��3H2(g) ��H1
C10H12(l)��3H2(g) ��H1
C10H12(l)![]() C10H8(l)��2H2(g) ��H2
C10H8(l)��2H2(g) ��H2
��H1����H2��0��C10H18��C10H12�Ļ��ΪEa1��C10H12��C10H8�Ļ��ΪEa2��ʮ�����ij�ѹ�е�Ϊ192������192����Һ̬ʮ���������ⷴӦ��ƽ��ת����ԼΪ9������ش�
��1�����������������Ӧƽ��ת���ʵ�������_________��
A�����¸�ѹ B�����µ�ѹ C�����µ�ѹ D�����¸�ѹ
��2���о���������������ʮ�������ں����ܱշ�Ӧ���У������¶ȴ�����ѹ����������Ҳ���������⣬������______________________________________________________��
��3���¶�335�����ں����ܱշ�Ӧ���н��и�ѹҺ̬ʮ������1.00 mol��������ʵ�飬���C10H12��C10H8�IJ���x1��x2�������ʵ��������ƣ���ʱ��仯��ϵ����ͼ1��ʾ��
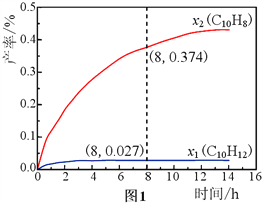

����8 hʱ����Ӧ��ϵ����������Ϊ__________mol��������������Ӧ����
��x1��������x2��ԭ����________________________________________��
����ͼ2�л�����C10H18��C10H12��C10H8��������������Ӧ������ʾ��ͼ��
������ѧ�ҷ��֣���H2O��N2Ϊԭ�ϣ�����NaOH��KOHΪ����ʣ�����Fe2O3����������250���ͳ�ѹ�¿�ʵ�ֵ绯ѧ�ϳɰ��������������ı仯����Ϊ���������У��벹��������
��4���缫��Ӧʽ��________________________________��2Fe��3H2O��N2��Fe2O3��2NH3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MgSO4��Al2(SO4)3�Ļ����Һ�У���μ���NaOH��Һ������ͼ���У�����ȷ��ʾ������Ӧ����(�������ʾ����NaOH��Һ��������������ʾ��Ӧ���ɳ���������) (����)

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ���������;����ȷ���Ҿ��ж�Ӧ��ϵ����( )
A.������������ˮ��������ľ�ķ����
B.С�մ�����Ӧ�����������ɼ�
C.��������Ư���ԣ�����������ˮ������
D.Һ������ʱҪ���մ������ȣ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ұ��������Ʊ���ϩ��Ӧ��

����˵���в���ȷ����(����)
A. �ұ���һ�ȴ��ﹲ��3�ֲ�ͬ�ṹ
B. ����ϩ�����������ұ��ķ�Ӧ���ڼӳɷ�Ӧ
C. ����ϩ����������ԭ���п���λ��ͬһƽ����
D. �������ı���ϩ�;۱���ϩȼ�պ�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.�������Ӽ��ȶ������Ӽ���ȫ
B.��Ȼ���Ӽ����˹��ϳ����Ӽ���ȫ
C.���̷������������谷(��ѧʽΪC3H6N6)��Υ����
D.���÷�����������ʳƷ���÷�����������ʳƷ��ȫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A. �ᡢ��ζ��ǵ����
B. ���ܵ�����һ�����ǵ����
C. �����ﶼ�ǵ����
D. �⻯�ﶼ���ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���մɵķ������������ڿ�ѧ������չʷ�ϵ�һ����Ҫ��̱����մɲ����е�������
A.����B.�����C.������D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ��������Ҫ�Ļ����Լ���һЩ���ʼ��Ʊ��������£�
�Ȼ������۵�306�����е�315��,�����տ����е�ˮ�ֶ���������ҵ�ϲ�����500600����������ͨ��������������ˮ�Ȼ�����
�Ȼ��������۵�670��,����������ҵ�ϲ��������������ͨ���Ȼ�����������ˮ�Ȼ�������ʵ���ҿ�����ͼ��ʾ��װ��ģ�ҵ������ˮ�Ȼ�������ش�������⡣

��1��װ��A����KMnO4������Ũ���ᷴӦ����������Ӧ�����ӷ���ʽΪ______________��
��2��������a�������������_____________��װ�ò��ýϴֵĵ���������װ���۵�Ӳ�ʲ����ܺ��ƿC����Ŀ����____________________��
��3������b ��Ӧ�� (�����߿�װ����ѡ��װ�õ���ĸ���)���ӣ������ɱ��ⷴӦϵͳ�뻷������Ӱ����
��4��ʵ����ɺ�ȡ���ƿC���ռ����IJ���������²ⶨ������
�ٳ�ȡ4.52g��Ʒ���ڹ�����ϡ�����У��ڼ�������H2O2�����ټ�������NaOH��Һ���ܹ��ˡ�ϴ�Ӻ����ճ������ݳ������ú���ɫ����Ϊ2.40g�������Ʒ��FeԪ�ص���������Ϊ________%��
��5�����Ϸ������ݺͼ���ó����ۣ��ô�װ���Ƶõ���ˮ�Ȼ���������ƫ�ߣ���Ȼ���к��н϶��FeCl2������
�ٲ���FeCl2���ʵ�ԭ����___________________��
����Ҫ�õ��ϴ�������ˮ�Ȼ������ɲ�ȡ��װ�øĽ���ʩ��______________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com