
|
已知:①CO(g)+H2O(g) ②CH4(g)+CO2(g) ③CH4(g)+H2O(g) 若反应③在1L的密闭容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示.下列有关叙述错误的是
| |
| [ ] | |
A. |
ΔH3=+206.1 kJ·mol-1 |
B. |
反应③进行到10 min时,改变的外界条件可能是升高温度 |
C. |
反应③进行的过程中,0~5 min这段时间共吸收的热量为103.05 kJ |
D. |
当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大 |
科目:高中化学 来源: 题型:
 已知:①CO(g)+
已知:①CO(g)+| 1 |
| 2 |
|
| 1 |
| 2 |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
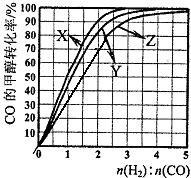
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
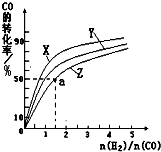
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
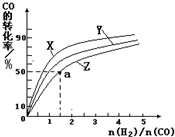
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省江门市高考模拟考试理综化学试卷(解析版) 题型:计算题
工业合成氨的反应为:N2(g)+3H2(g)  2NH3(g) △H <0
2NH3(g) △H <0
某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
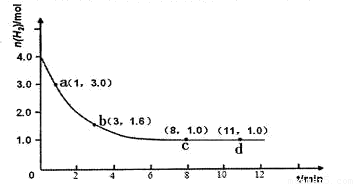
(1)反应开始3min内,H2的平均反应速率为 。
(2)计算该条件下合成氨反应的化学平衡常数(写出计算过程,结果保留2位有效数字)。
(3)仅改变温度为T2 ( T2小于TI)再进行实验,请在答题卡框图中画出H2的物质的量随反应时间变化的预期结果示意图。
(4)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C+H2O(g)
 CO+H2;②CO+H2O(g)
CO+H2;②CO+H2O(g)  CO2+H2;
CO2+H2;
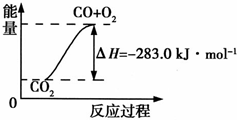
已知:CO(g)+1/2O2(g)=CO2(g) △H=—283.0kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=—241.8kJ/mol
写出上述CO与H2O(g)反应的热化学方程式: 。
(5)合成氨工业中,原料气(N2、H2混有少量CO、NH3)在进入合成塔之前,用醋酸二氨合铜(I)溶液来吸收CO,其反应为:
CH3COO[Cu(NH3)2]+CO+NH3 CH3COO[Cu(NH3)3]•CO
△H<0
CH3COO[Cu(NH3)3]•CO
△H<0
写出提高CO吸收率的其中一项措施: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com